Йодометрический метод анализа основан на окислительно-восстановительных реакциях, связанных с восстановлением J 2 до J --ионов и с окислением J--ионов до J2:
J2 + 2e↔ 2J- 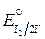 - = 0,536 B
- = 0,536 B
Кристаллический йод малорастворим в воде. Поэтому обычно применяют раствор йода с KJ, в котором йод связан в комплексное соединение с иодид-ионом:
J2 + J-↔[J3]- 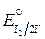 = 0,545 B
= 0,545 B
Методом йодометрии можно определять как окислители, так и восстановители. Восстановители, такие, у которых окислительно-восстановительный потенциал пары меньше 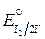 на 0,2 В, титруют непосредственно стандартным раствором йода. Такие методы определения называют методами прямого йодометрического титрования. Так определяют сульфиды, сульфиты, тиосульфаты и другие сильные восстановители. В качестве индикатора применяют специфический реактив на йод – раствор крахмала, образующий с йодом адсорбционно-комплексное соединение интенсивно фиолетово-синего цвета. При титровании в присутствии крахмала конечную точку титрования определяют по появлению фиолетово-сине-серой окраски анализируемого раствора, вызываемой одной лишней каплей титранта – раствора йода.
на 0,2 В, титруют непосредственно стандартным раствором йода. Такие методы определения называют методами прямого йодометрического титрования. Так определяют сульфиды, сульфиты, тиосульфаты и другие сильные восстановители. В качестве индикатора применяют специфический реактив на йод – раствор крахмала, образующий с йодом адсорбционно-комплексное соединение интенсивно фиолетово-синего цвета. При титровании в присутствии крахмала конечную точку титрования определяют по появлению фиолетово-сине-серой окраски анализируемого раствора, вызываемой одной лишней каплей титранта – раствора йода.
|
|
|
Стандартный раствор йода можно приготовить растворением точной навески химически чистого кристаллического йода в мерной колбе.
Окислители, у которых окислительно-восстановительный потенциал пары больше, чем 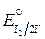 на 0,2 В, определяют методом заместительного титрования. Для этого растворы окислителей обрабатывают избытком йодида калия, а затем выделившийся в эквивалентном окислителю количестве элементарный йод, оттитровывают стандартным или стандартизованным раствором тиосульфата натрия Na2S2O3. Так определяют MnO4-, Cr2O72-, ClO3-, Cl2, Br2, соли меди (II), нитриты, пероксид водорода и другие окислители.
на 0,2 В, определяют методом заместительного титрования. Для этого растворы окислителей обрабатывают избытком йодида калия, а затем выделившийся в эквивалентном окислителю количестве элементарный йод, оттитровывают стандартным или стандартизованным раствором тиосульфата натрия Na2S2O3. Так определяют MnO4-, Cr2O72-, ClO3-, Cl2, Br2, соли меди (II), нитриты, пероксид водорода и другие окислители.
В некоторых случаях применяют метод йодометрического титрования остатка первого титранта (обратное титрование). При этом к раствору определяемого компонента (например, S2--ионов) добавляют избыточное количество стандартного раствора йода, и остаток не вступившего в реакцию с восстановителем раствора J 2 оттитровывают стандартным или стандартизованным раствором тиосульфата натрия.
Конец реакции между йодом и тиосульфатом устанавливают по изменению окраски раствора крахмала. В йодометрии (особенность метода) раствор крахмала добавляют в титруемый раствор в конце титрования вблизи точки эквивалентности, когда раствор станет соломенно-желтого цвета. Это связано с тем, что крахмал, добавленный к раствору с высокой концентрацией йода, разрушается с образованием продуктов, теряющих чувствительность к йоду. Кроме того, соединение йода с крахмалом медленно реагирует с тиосульфатом, поэтому раствор можно легко перетитровать и получить завышенные результаты анализа.
|
|
|
Титрование йода раствором тиосульфата натрия Na2S2O3происходит по уравнению реакции
J2 + 2 Na 2 S 2 O 3 ↔ 2 Na J + Na 2 S 4 O 6
Стандартный раствор тиосульфата натрия можно приготовить из стандарт – титра – «фиксанала» Na2S2O3, точно отмеренного количества реактива Na2S2O3, х.ч, в заводских условиях и запаенного в стеклянную ампулу. Стандартный раствор тиосульфата натрия по точной навеске реактива Na2S2O3 в лабораторных условиях приготовить нельзя, т. к. кристаллический Na2S2O3 легко теряет кристаллизационную воду, окисляется кислородом воздуха и поглощает углекислый газ. Приготовленный раствор Na2S2O3 оставляют на 7 – 10 дней в темном месте для стабилизации и затем приступают к его стандартизации.
Для стандартизации раствора тиосульфата натрия используют вещества сравнения – реактивы квалификации х.ч. – дихромат калия K2Cr2O7, или йодат калия KJO3, или бромат калия KBrO3, или гидро-йодат калия KH(JO3)2. Например, из предварительно высушенного реактива K2Cr2O7 готовят стандартный раствор K2Cr2O7 растворением в мерной колбе точной навески, измеренной на аналитических весах 2-го класса точности.
В этом случае молярную концентрацию эквивалентов Na2S2O3 определяют следующим способом. К аликвоте стандартного раствора K2Cr2O7добавляют расчетное избыточное количество раствора KJ и H2SO4. Выделившееся в результате окислительно-восстановительной реакции эквивалентное количество J2, которое будет играть роль заместителя взятого эквивалентного количества K2Cr2O7, титруют раствором Na2S2O3. При этом протекают следующие реакции:
K 2 Cr 2 O 7 +6 KJ+ 7 H2SO4 = 3 J2 + Cr2(SO4)3 + 4 K2SO4 + 7H2O
3 J2 + 6 Na 2 S 2 O 3 = 6 NaJ + 3 Na2S4O6
Согласно закону эквивалентов
nэ(K 2Cr2O7) = nэ (J2) = nэ(Na 2S2O3)или nэ(K 2Cr2O7) = nэ(Na 2S2O3)
Измерив по бюретке эквивалентный объём титранта Na2S2O3, израсходованный на реакцию с J2, количество которого эквивалентно количеству K2Cr2O7, рассчитывают молярную концентрацию эквивалентов Na2S2O3:
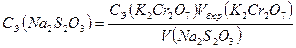 ; (моль/дм3)
; (моль/дм3)
Стандартный и стандартизованный растворы Na2S2O3 хранят в склянке из темного стекла.
 2015-06-14
2015-06-14 6023
6023








