Рис. 11.
а) адсорбционный слой ПАВ на гидрофобной поверхности
б) адсорбционный слой ПАВ на гидрофильной поверхности
· Инверсия смачивания широко используется в текстильной технологии (окраска, пропитка и др.), в фармацевтической технологии при производстве композиционных лекарственных форм, при стирке, флотации и др.
3.2. Адсорбция. Виды адсорбции. Уравнения Ленгмюра и Фрейндлиха.
· Адсорбция – концентрирование вещества из объема фаз на поверхности раздела между ними. Адсорбция может рассматриваться как поглощение вещества (адсорбата) поверхностью адсорбента.
· Адсорбент – вещество, на поверхности которого протекает адсорбция.
· Адсорбтив – газ или растворенное вещество, способное адсорбироваться на поверхности адсорбента.
· Адсорбат – адсорбированное вещество, находящееся на поверхности адсорбента. Часто понятия «адсорбтив» «адсорбат» отождествляются
· Различают физическую адсорбцию, происходящую без химического изменения адсорбата и химическую адсорбцию (хемосорбцию), сопровождающуюся химическим взаимодействием адсорбтива с адсорбентом.
· Адсорбция бывает на границах раздела фаз: твердое тело – жидкость, твердое тело – газ, жидкость – газ, жидкость – жидкость.
· Если вещество адсорбируется в виде молекул, говорят о молекулярной адсорбции, в виде ионов – ионной адсорбции.
· Адсорбция – обратима, обратный процесс называют десорбцией.
· Скорости адсорбции и десорбции равны между собой при адсорбционном равновесии, которому соответствует равновесная концентрация адсорбата в растворе или равновесное давление в газовой фазе.
· Величина адсорбции (А) характеризуется равновесным количеством поглощаемого вещества (Х), приходящимся на единицу массы твердого адсорбента (m): 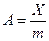 [моль/кг или кг/кг]
[моль/кг или кг/кг]
· Изотерма адсорбции – графическое отображение зависимости величины адсорбции от равновесной концентрации или равновесного давления при данной постоянной температуре.
· Различают адсорбцию мономолекулярную, при которой адсорбат покрывает поверхность адсорбента слоем толщиной в одну молекулу и полимолекулярную, при которой молекулы адсорбата могут располагаться на поверхности адсорбента в несколько слоев.
· Изотерма мономолекулярной адсорбции имеет вид, изображенный на рис. 12 (изотерма Ленгмюра)





 А Участок I – отвечает малым равновесным концентрациям (давлениям), когда небольшая часть поверхности адсорбента занята молекулами адсорбата, а зависимость А – с (р) линейна;
А Участок I – отвечает малым равновесным концентрациям (давлениям), когда небольшая часть поверхности адсорбента занята молекулами адсорбата, а зависимость А – с (р) линейна;






 А¥ Участок II – средним концентрациям (давлениям) при которых значительная доля поверхности адсорбента занята молекулами адсорбата;
А¥ Участок II – средним концентрациям (давлениям) при которых значительная доля поверхности адсорбента занята молекулами адсорбата;


 I II III c (р)Участок III – наблюдается при высоких равновес-
I II III c (р)Участок III – наблюдается при высоких равновес-
ных концентрациях (давлениях), когда вся поверхность адсорбента занята молекулами адсорбата и достигнута предельная величина адсорбции (А¥).
· Изотерма мономолекулярной адсорбции хорошо описывается уравнением Ленгмюра:
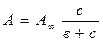
 или
или 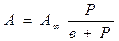
где в, А¥ константы, индивидуальные для каждого отдельного вещества при адсорбции на конкретном адсорбенте;
с, р – равновесная концентрация или равновесное давление.
· При малых равновесных концентрациях можно пренебречь величиной с или р в знаменателе. Тогда уравнение Ленгмюра преобразуется в уравнение прямой, проходящей через начало координат:
А = А¥ × в × с или А =А¥ × в × р
· При больших равновесных концентрациях можно пренебречь в знаменателе величиной в. Тогда уравнение Ленгмюра преобразуется в уравнение прямой не зависящей от с или р: А = А¥
· Для практических расчетов необходимо знать константы уравнения Ленгмюра А¥ и в. Преобразование уравнения в линейную форму прямой, не проходящей через начало координат: 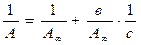 , позволяет строить график зависимости 1/А - 1/с (рис. 13).
, позволяет строить график зависимости 1/А - 1/с (рис. 13).



 1/А Отрезок ОВ равен 1/А¥. Коэффициент в можно найти, исходя из того, что в равен концентрации, при которой величина адсорбции составляет половину от предельной.
1/А Отрезок ОВ равен 1/А¥. Коэффициент в можно найти, исходя из того, что в равен концентрации, при которой величина адсорбции составляет половину от предельной.
2/А¥ В
1/А¥
О Д 1/С (1/Р)
Рис. 13.
На графике интерполяцией определяется отрезок ОД, соответствующий 2/А¥ и равный 1/в. Тогда в = 1/ОД.
· Уравнение Ленгмюра было выведено на основе теории мономолекулярной адсорбции, которая имеет следующие основные положения:
- адсорбция молекул происходит только на адсорбционных центрах (вершины неровностей и узкие поры);
- каждый адсорбционный центр может удерживать только одну молекулу адсорбата;
- процесс адсорбции обратим; адсорбционное равновесие носит динамический характер. Адсорбированные молекулы удерживаются адсорбционными центрами только определенное время, после чего происходит десорбция этих молекул и адсорбция того же числа новых молекул.
· Кроме уравнения Ленгмюра на практике часто используется уравнение Фрейндлиха:
А = КС1/n или А = КР1/n, где К и 1/n – константы эмпирические.
Уравнение более подходит для описания адсорбции на пористых или порошкообразных адсорбентах в области средних концентраций (давлений).
· 


 Изотерма адсорбции Фрейндлиха не имеет горизонтальной прямой и адсорбция с ростом концентрации (давления) увеличивается (рис. 14).
Изотерма адсорбции Фрейндлиха не имеет горизонтальной прямой и адсорбция с ростом концентрации (давления) увеличивается (рис. 14).
А


 lg A N
lg A N

 Д М
Д М

В
О
с, (р) lg с (lg р)
Рис. 14 Рис. 15
· Для нахождения констант уравнения Фрейндлиха оно преобразуется с момощью логарифмирования в уравнение прямой, не проходящей через начало координат: lg А = lg К + 1/n lg С.
В соответствии с этим график зависимости lg А от lg С или (Р), построенный по экспериментальным данным имеет вид, показанный на рис. 15. Экстраполяцией на ось ординат получают отрезок ОВ равный lg К. Тангенс угла наклона прямой ВN к оси абсцисс равен 1/n (tg a = 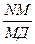 )
)
· Полимолекулярная адсорбция – наблюдается при адсорбции на пористых или порошкообразных адсорбентах (силикагель, активированный уголь, порошки и таблетки лекарственных веществ). В этом случае адсорбция продолжается до образования плотного мономолекулярного слоя, как показано на рис. 16.
 адсорбат А
адсорбат А
 |  |
адсорбент
 |
 Рис. 16. с, (р)
Рис. 16. с, (р)
Рис. 17.
Такой адсорбции отвечает изотерма другого вида (рис. 17), так называемая «S – изотерма».
· Капиллярная конденсация – явление сжижения пара в порах или капиллярах твердого адсорбента, она наблюдается при поглощении легко сжижающихся газов или паров (например, воды, бензола и др.) в результате полимолекулярной адсорбции. При этом полимолекулярный слой представляет собой тончайшую пленку жидкости, покрывающую внутреннюю поверхность поры. Сливающиеся друг с другом в узких местах слои такой жидкости образуют вогнутые мениски, под которыми создается пониженное давление пара. Благодаря этому поры втягивают в себя молекулы газа (пара) и заполняются жидкостью, образующейся при конденсации.
· При протекании адсорбции, осложненной капиллярной конденсацией, изотерма отвечающая заполнению пор (1) не совпадает с изотермой (2), отвечающей их опорожнению (рис. 18). На изотерме образуется петля конденсационного гистерезиса. Процессы адсорбции и десорбции не совпадают.
А
 |

р
Рис. 18.
3.3. Особенности адсорбции на границе раздела фаз твердое тело – жидкость. Экспериментальное определение адсорбции.
· Адсорбция из растворов на твердых адсорбентах имеет свои особенности: адсорбционное равновесие устанавливается медленно; большие затраты энергии адсорбатом на вытеснение с поверхности адсорбента молекул растворителя, связанных с ним адгезионными силами.
· При адсорбции из раствора молекул поверхностно-активных веществ на поверхности адсорбента они ориентируются так, чтобы полярная часть дифильной молекулы была обращена к полярной фазе (рис. 19, а), а неполярная часть – к неполярной (рис. 19, б).
 |  |  |







 бензол вода
бензол вода





















 / / / / / / / / / / / / / / / / / / / / / /
/ / / / / / / / / / / / / / / / / / / / / /
силикагель уголь
Рис. 19.
а) б)
· Чем хуже растворитель смачивает поверхность адсорбента и чем хуже растворяет вещество, тем лучше будет происходить адсорбция растворенного вещества.
· Правило уравнивания полярностей (П.А. Ребиндер): вещество (С) может адсорбироваться на поверхности раздела фаз (А и В), если при адсорбции будет уравниваться полярность этих фаз, т.е. полярность вещества должна быть промежуточной между веществами, составляющими фазы: eА > eС > eВ или eА< eС< eВ, где  e - диэлектрическая проницаемость.
e - диэлектрическая проницаемость.
· Адсорбционная способность вещества зависит от ряда факторов:
- чем больше молярная масса вещества, тем больше его адсорбируемость;
- ароматические соединения адсорбируются лучше, чем алифатические с такой же или близкой молярной массой, а непредельные – лучше, чем насыщенные;
- чем ниже температура, тем больше адсорбируемость вещества, т.к. процесс адсорбции сопровождается выделением тепла (экзотермический).
· Экспериментально величину адсорбции (А) на границе твердое тело – жидкость рассчитывают по уравнению: 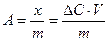 , где
, где
С – разность между начальной и равновесной концентрацией вещества в растворе (моль/л);
V – объем раствора (л);
m – масса адсорбента (кг).
· Практическое значение адсорбции огромно: очистка растворов от примесей; осветление сиропов, настоек, соков, вин; извлечение малых количеств веществ, растворенных в больших объемах жидкости (технология редких элементов); адсорбционная хроматография (технология витаминов, пигментов, очистка лекарственных веществ, воды и др.)
3.4. Адсорбция ионов из водных растворов электролитов.
· Сильные электролиты адсорбируются в виде ионов. Ионная адсорбция имеет ряд особенностей:
- скорость ионной адсорбции меньше скорости молекулярной адсорбции;
- ионная адсорбция не всегда обратима, т.к. может сопровождаться хемосорбцией;
- при ионной адсорбции на поверхности адсорбента возникает определенный заряд, который притягивает из раствора противоположно заряженные ионы, в результате на границе раздела фаз возникает двойной электрический слой;
- адсорбируемость ионов определяется величиной их заряда, радиусом и степенью сольватации;
- при равенстве заряда лучше адсорбируются ионы с большим радиусом, т.к. они менее сольватированы;
- по величине адсорбции ионы располагаются в лиотропные ряды, которые для водных систем выглядят так:
 |
увеличение адсорбируемости

катионы: Li+ < Na+ < K+ < Pb+ < Cs+
анионы: F - < Cl - < Br - < NO3- < I - < CNS -
 |
увеличение степени гидратированности
 |
- многозарядные ионы адсорбируются лучше однозарядных. Исключение составляет катион водорода, обладающий наибольшей адсорбционной способностью.
Na+ < K+ < NH4+ < Mg2+ < Ca2+ < Ba2+ < Al3+ < Fe3+< H +
 |
увеличение адсорбции
 |
- если в растворе электролитов имеются такие же ионы, как и в составе твердого адсорбента, то ионная адсорбция принимает строго избирательный характер, описываемый правилом Панета-Фаянса.
- Правило Панета – Фаянса: на поверхности кристалла преимущественно адсорбируются те ионы, которые входят в состав кристаллической решетки адсорбента и могут ее достроить.
· Ионообменная адсорбция – это явление эквивалентного обмена собственных ионов нерастворимого адсорбента, посылаемых в раствор, на другие ионы того же знака, находящиеся в растворе.
· Адсорбенты, способные к обмену ионов с раствором, называются ионитами или ионообменниками.
· Классификация ионитов: 1) по происхождению: природные (глауконит, гумусовые вещества почв) и искусственные (пермутиты – алюмосиликаты, синтетические ионообменные смолы);
2) по кислотно-основным свойствам – катиониты (вещества кислотного типа, обменивающиеся катионами) и аниониты (вещества основного типа, обменивающиеся анионами); амфотерные иониты (амфолиты), содержащие и катионные и анионные обмениваемые группы.
· Ионообменные смолы – это высокомолекулярные нерастворимые соединения, способные к набуханию в воде и к высвобождению ионов в процессе электролитической диссоциации.
· Обменная емкость – способность ионита обменивать противоионы. Она определяется числом молей (или миллимолей) извлекаемых из раствора ионов в расчете на единицу массы сухого ионита.
· Ионообменная адсорбция используется в медицинской практике для очистки воды, консервирования крови (удаление катионов Са2+), беззондовой диагностики кислотности желудочного сока, детоксикации организма при различных отравлениях, нормализации ионного баланса в организме. В фармации иониты используют для аналитических целей – извлечение из смеси анализируемого вещества. В агротехнике, при выращивании лекарственных растений – для улучшения структуры почв.
· Умягчения жесткой воды проводят путем пропускания воды через катионит, (например КУ-1, КУ-2) в Na-форме:
 SO3Na SO3
SO3Na SO3





 катионит + Са 2+ + 2Cl - катионит Ca + 2Na+ + 2Cl -
катионит + Са 2+ + 2Cl - катионит Ca + 2Na+ + 2Cl -
SO3Na SO3
· Обессоливание воды (деминерализацию) проводят путем последовательного пропускания ее через катионит в Н-форме и анионит (например, АН-1) в ОН-форме

 катионит - SO3H + Na+ + Cl - катионит - SO3Na + H+ + Cl -
катионит - SO3H + Na+ + Cl - катионит - SO3Na + H+ + Cl -

 анионит - NH3OH + H+ + Cl - катионит - NH3Cl - + H2O
анионит - NH3OH + H+ + Cl - катионит - NH3Cl - + H2O
· Регенерация ионитов – восстановление первоначального состояния ионита. Для перевода в Н-форму катионит обрабатывается концентрированными растворами кислот, регенерация анионита в ОН-форму осуществляется выдерживанием в растворах NaOH.
3.5. Хроматография. Хроматографические методы.
· Хроматография – физико-химический метод разделения и анализа смесей веществ, основанный на процессах сорбции и десорбции разделяемых веществ между подвижной и неподвижной фазами, что приводит к различию в скорости движения этих веществ относительно неподвижной фазы.
· Эффективность хроматографического процесса зависит от:
- физико-химических свойств неподвижной и подвижной фаз;
- условий хроматографирования (температуры, времени разделения, скорости движения подвижной фазы);
- сродства разделяемых веществ к контактирующим фазам.
· Различают следующие виды хроматографии:
По цели проведения:
- аналитическая хроматография используется для качественного и количественного анализа смеси веществ;
- препаративная хроматография предназначена для выделения из смеси чистых компонентов или для очистки вещества от примесей.
По агрегатному состоянию подвижной фазы:
- газовая хроматография, где подвижной фазой является газ, а неподвижной фазой твердый адсорбент;
- жидкостная хроматография, когда подвижной фазой является, как чистая жидкость, так и смесь разных жидкостей.
· По технике эксперимента:
- плоскостная (тонкослойная или бумажная) хроматография, когда в качестве твердой фазы используются силикагель, оксид алюминия, нанесенные тонким слоем на пластину. В бумажной хроматограмме неподвижной фазой является вода, входящая в состав бумаги;
- объемная (колоночная) хроматография. В этом случае в верхнюю часть колонки с сорбентом вносят анализируемую смесь и медленно пропускают подвижную фазу.
· По механизму разделения веществ:
- адсорбционная хроматография, когда вещества разделяются благодаря различию их констант адсорбции в системах «газ - твердое тело» или «раствор - твердое тело».
- распределительная хроматография при которой разделение веществ происходит вследствие различия констант распределения при адсорбции веществ из газовой или жидкой подвижной фазы жидкой неподвижной фазой, нанесенной на твердый носитель.
- молекулярно-ситовая (гель-фильтрация) хроматография, когда разделение смеси веществ происходит благодаря различному размеру их частиц. Неподвижной фазой служат вещества, имеющие поры строго определенного размера (цеолиты, или агарозы, полиакриламидные гели и др.).
- биоспецифическая хроматография основана на способности биологических субстратов избирательно взаимодействовать с веществами, например, фермента с субстратом, антигена с антителом, гормона с рецептором.
Хроматография широко применяется в медицине, биологии, фармации для:
- качественного и количественного анализа лекарственных веществ;
- идентификации продуктов деструкции образующихся при длительном хранении лекарственных веществ;
- обнаружения примесей, оценки чистоты лекарственных веществ;
- качественного и количественного анализа биологических жидкостей (кровь, моча) на присутствие в ней алкоголя, наркотиков, допинга.
- качественного и количественного соотношения жирных кислот в физиологических средах для диагностики заболеваний желчного пузыря, печени, сахарного диабета, гипертонической болезни и др.;
- контроля окружающей среды, в гигиене и санитарии.
Вопросы для самопроверки
1. Что такое адгезия и когезия?
2. Что такое «контур смачивания»? Краевой угол смачивания? Как измеряется краевой угол смачивания?
3. Какова величина краевого угла смачивания, если поверхность не смачивается данной жидкостью? Если смачивается?
4. С помощью какого уравнения можно рассчитать cos О?
5. Что называется теплотой смачивания?
6. Как рассчитать коэффициент гидрофильности?
7. Что называется инверсией смачивания?
8. Что называется адсорбентом и адсорбатом?
9. В чем отличие физической и химической адсорбции?
10. Почему один из участков изотермы мономолекулярной адсорбции имеет вид горизонтальной прямой?
11. Как записать уравнение Ленгмюра и Фрейндлиха?
12. Чем отличаются изотермы адсорбции Фрейндлиха и Ленгмюра?
13. Как найти константы в уравнении Фрейндлиха, используя графический способ?
14. Как найти константы в уравнении Ленгмюра, используя зависимость 1/А – 1/с?
15. Что такое петля гистерезиса?
16. Как вычислить величину адсорбции, используя экспериментальные данные?
17. Как формулируется правило уравнивания полярностей Ребиндера?
18. Как ориентируются молекулы ПАВ у поверхности адсорбента?
19. Каково практическое значение адсорбции на границе «твердое тело – раствор»?
20. Что такое ионная адсорбция?
21. Почему при ионной адсорбции на границе раздела фаз возникает двойной электрический слой?
22. Как адсорбируемость ионов зависит от степени гидратированности одновалентных ионов?
23. Как формулируется правило Панета-Фаянса?
24. Что называется ионообменной адсорбцией?
25. Какие вещества называются ионитами? Приведите примеры.
26. Как классифицируются иониты?
27. Что такое обменная емкость ионита?
28. Для чего используется ионообменная адсорбция?
29. Как проводится умягчение и обессоливание воды?
30. Что такое регенерация ионитов? Как она проводится?
31. Как классифицируются хроматографические методы по цели проведения и технике исполнения?
32. Какие известны виды хроматографии по механизму разделения веществ?
33. Как используется хроматография?
Решение типовых задач
Задача 1. Определить графическим способом константы (К и 1/n) в уравнении изотермы адсорбции Фрейндлиха, если при адсорбции уксусной кислоты на активированном угле были получены данные:
| Равновесная концентрация С, моль/л | 0,018 | 0,039 | 0,062 | 0,126 |
| Адсорбция А, моль/кг | 0,467 | 0,660 | 0,801 | 1,111 |
Рассчитать величину адсорбции при равновесной концентрации Сх = 0,047 моль/л
Решение:
Для нахождения констант уравнения Фрейнлиха строят график зависимости lgA = f (lgC). Для этого логарифмируют исходные данные и строят по ним график.
| lg C | - 1,74 | - 1,41 | - 1,21 | - 0,89 |
| lg A | - 0,33 | - 0,18 | - 0,09 | 0,05 |
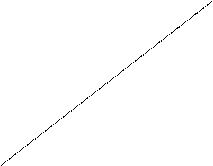 lgA График отсекает от оси ординат отрезок
lgA График отсекает от оси ординат отрезок
 ОВ равный lg k = 0,42; k = 10x = 2,63. По
ОВ равный lg k = 0,42; k = 10x = 2,63. По
B угловому коэффициенту графика находят
коэффициент 1/n.
 tg a
tg a 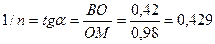
lg C M 0 Проводят расчет величины адсорбции при
Сх по уравнению Фрейндлиха: А = КС1/n =
2,63 × 0,0470,429 = 0,708 моль/кг.
Задача 2. При изучении адсорбции бензойной кислоты на активированном угле были получены данные:
| Равновесная концентрация С, кмоль/м3 | 1,26 | 2,68 | 4,71 | 8,82 |
| Адсорбция А × 1010, кмоль/кг | 11,1 | 15,5 | 20,4 | 24,8 |
Определить графическим способом константы уравнения Ленгмюра и рассчитать величину адсорбции при равновесной концентрации Сх = 6,15 кмоль/м3
Решение:
Для нахождения констант уравнения Ленгмюра строят график зависимости 1/A = f (1/C). Для этого находят значения: 1/С и 1/А и откладывают их на графике.
| 1/C | 0,79 | 0,37 | 0,21 | 0,11 |
| 1/A×1010 | 0,09 | 0,06 | 0,05 | 0,04 |

 1/А×1010 На графике отрезок ОВ отсекает на оси ординат 1/А¥ ×1010 = 0,03. Следовательно, 1/А¥ = 1/0,03 ×1010 = 33,33 ×1010. Для нахождения второго коэффициента в находят величину отрезка ОК = 2/А¥ = 0,06. Если ВО = ОК, то 1/ в= ОМ, тогда
1/А×1010 На графике отрезок ОВ отсекает на оси ординат 1/А¥ ×1010 = 0,03. Следовательно, 1/А¥ = 1/0,03 ×1010 = 33,33 ×1010. Для нахождения второго коэффициента в находят величину отрезка ОК = 2/А¥ = 0,06. Если ВО = ОК, то 1/ в= ОМ, тогда 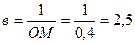
1/С Расчет величины адсорбции при Сх по уравнению Ленгмюра:
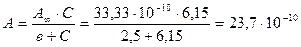
кмоль/кг
Задача 3. Определить равновесную концентрацию сульфацила натрия при адсорбции его на активированном угле, если константы уравнения Фрейндлиха К = 2,58 и 1/n = 0,64. Величина адсорбции 0,916 моль/кг.
Решение:
1. Для нахождения равновесной концентрации по уравнению Фрейндлиха удобно его прологарифмировать: lg A = lg K + 1/n lg C, тогда
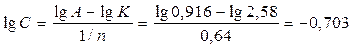
С = 10х = 10- 0,703 = 0,198 моль/кг
2. Возможно и такое решение: А = КС1/n
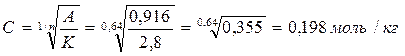
Задача 4. Рассчитать величину адсорбции паров этанола на активированном угле при равновесном давлении р = 3240 Па. Константы уравнения Ленгмюра А¥ = 0,0258; в = 140.
Решение: Для расчета используем уравнение Ленгмюра:
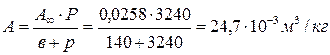
Задачи для самостоятельного решения
1 – 5. По данным таблицы рассчитайте величину адсорбции по уравнению Ленгмюра для вещества при равновесной концентрации Сх и давлении Рх, определив константы уравнения графическим способом.
| № задачи | Вещество | Равновесная концентрац. С моль/л | Равновесное давление Р, Па | Адсорбция х/m, моль/кг | Сх, моль/л | Рх, Па |
| Уксусная кислота | 0,18; 0,31; 0,62; 1,26 | - | 4,67; 6,24; 8,01; 11,1 | 0,45 | - | |
| Окись углерода | - | 7300; 3040; 5400; 8824 | 2,34; 7,84; 11,9; 16,5 | - | ||
| Пропионовая кислота | 0,3; 0,48; 0,58; 0,91 | - | 2,6; 3,2; 3,4; 4,0 | 0,62 | - | |
| Этиловый спирт | 0,9; 1,84; 2,6; 5,2 | - | 8,4; 17,0; 24,6; 37,4 | 4,8 | - | |
| Аммиак | - | 5100; 6380; 7660; 8980 | 8,4; 9,2; 10,0; 11,2 | - |
6 – 10. По данным таблицы графическим способом определите константы в уравнении Фрейндлиха (1/n и К) и величину адсорбции при Сх, и давлении Рх.
| № задачи | Вещество | Равновесная концентрац. С моль/л | Равновесное давление Р, Па | Адсорбция х/m, моль/кг | Сх, моль/л | Рх, Па |
| Капроновая кислота | 0,62; 1,26; 4,71; 8,82 | - | 8,01; 11,1; 20,4; 24,8 | 0,38 | - | |
| Альгинат натрия | 0,08; 0,27; 0,55; 1,20 | - | 4,6; 8,0; 10,6; 14,6 | 0,42 | - | |
| Пектин цитрусовый | 0,11; 0,04; 0,082; 0,182 | - | 0,68; 1,19; 1,58; 2,18 | 0,15 | - | |
| Пары метанола | - | 5140; 6420; 7700; 9020 | 8,9; 9,7; 10,5; 11,7 | - | ||
| Пары метанола | - | 1180; 2460; 3740; 5020 | 7,0; 7,5; 7,8; 8,1 | - |
Рекомендуемая литература:
Основная
1. Воюцкий С.С. Курс коллоидной химии, М.: Химия, 1975 С. 117-128, С. 404-415.
2. Евстратова К.И., Купина Н.А., Малахова Е.Е. Физическая и коллоидная химия /под ред. К.И. Евстратовой. – М.: Высш. шк., 1990. С.303-311, 320-325, 329-331.
3. Красовский И.В., Вайль Е.И., Безуглый В.Д. – Физическая и коллоидная химия – К.: Вища школа. – С. 176-179, 181-193, 196-198.
4. Фролов Ю.Г. Курс коллоидной химии. М.: Химия, 1976, С. 114-118, 155-158, 164-166, 288-304.
5. Практикум по физической и коллоидной химии. /Под ред. Евстратовой К.И. – М.: Высшая школа, 1990. – С.158-172, 180-186.
6. Гамеева О.С. Сборник задач по физической и коллоидной химии. М.: Высшая школа, 1980.
Дополнительная
1. Общая химия. Биофизическая химия. Химия биогенных элементов. /Под ред. Ю.А. Ершова, М.: Высшая школа. 1993. – С. 423-440.
2. Лукьянов А.Б. Физическая и коллоидная химия. – М.: Колос, 1984. – С. 10-13, 98-115.
3. Слесарев В.И. Химия: Основы химии живого – С.-Петербург: Химиздат, 2000, - С.684-698.
4. Фридрихсберг Ф.А. Курс коллоидной химии.- Л.: Химия, 1984.- С. 72-75, 80-85, 136-140.
Содержание
| Занятие 1 Сталагмометрическое определение поверхностного натяжения водных растворов ПАВ и расчет размеров их молекул………………………………………………. 1.1. Поверхностное натяжение……………………………… 1.2. Поверхностно-активные вещества…………………….. 1.3. Свойства поверхностно-активных веществ…………… 1.4. Сталагмометрическое определение поверхностного натяжения водных растворов ПАВ……………………. Вопросы для самопроверки…………………………….. Решение типовых задач………………………………… Задачи для самостоятельного решения………………... Занятие 2 Определение критической концентрации мицеллообразования ПАВ с использованием метода наибольшего давления пузырьков воздуха………………………… 2.1. Мицеллообразование. Критическая концентрация мицеллообразования (ККМ)…………………………… 2.2. Способы определения ККМ. Свойства мицеллярных растворов………………………………………………… Вопросы для самопроверки……………………………. Занятие 3 Адсорбция. Изучение адсорбции ПАВ на твердых адсорбентах………………………………………………… 3.1. Когезия. Адгезия. Растекание. Смачивание………… 3.2. Адсорбция. Виды адсорбции. Уравнение Ленгмюра и Фрейндлиха……………………………………………… 3.3. Особенности адсорбции на границе раздела «твердое тело - жидкость». Экспериментальное определение адсорбции………………………………………………... 3.4. Адсорбция ионов из водных растворов электролитов.. 3.5. Хроматография. Хроматографические методы……….. Вопросы для самопроверки……………………………. Решение типовых задач………………………………… Задачи для самостоятельного решения………………... Рекомендуемая литература………………………………………… |
Для записей
Поверхностные явления. Адсорбция: Учебное пособие для студентов /под ред. Богдашева Н.Н./
Учебное пособие разработано доцентом Мыкоц Л.П.
Технический редактор Т.М. Браташова
Подписано в печать «» 200 г
Формат 60х84/16 Бумага кн.-журнальная
Печать ротапринтная
Усл.-печ.л.
Тираж экз. Заказ № ____ Цена______
Пятигорская государственная фармацевтическая академия
357532, г. Пятигорск, пр. Калинина, 11.
Ротапринт ПятГФА. Г. Пятигорск, пр. Калинина, 11.
 2015-06-14
2015-06-14 3298
3298








