1. Активность. Коэффициент активности.
Ионная сила раствора. Термодинамическая константа диссоциации
В водных растворах электролитов наличие зарядов у ионов электростатически тормозит передвижение их. Поэтому концентрация растворённого вещества без учёта сил взаимодействия между ионами и молекулами в растворе не может полностью характеризовать свойства его. Чем выше концентрация раствора, содержащего многозарядные ионы, тем значительнее в нём силы взаимодействия между ионами и тем больше отклонения от закона действующих масс.
Способность ионов к химическим реакциям, вызываемая их электростатическим взаимодействием, характеризуется активностью.
Активность ионов связана с концентрацией вещества в растворе уравнением
α = g Cm, (1)
где α – активность ионов выражает эффективную концентрацию электролита в растворе (иначе «термодинамическую концентрацию»), имеет ту же единицу измерения, что и концентрация; g – моляльный коэффициент активности учитывает все те силы, которые действуют в растворе, и в первую очередь, силы электростатического взаимодействия между ионами. Коэффициент активности безразмерная величина. Он характеризует работу перенесения одного моля растворенного вещества из идеального в реальный раствор при Р, Т = const; Cm – моляльность вещества В в растворе, моль/1000 г Н2О или моль/кг Н2О.
В том случае, если раствор имеет молярную концентрацию вещества В, то уравнение (1) примет вид
α = у C, (1)
где у – молярный коэффициент активности; С – молярная концентрация вещества В, моль/л.
Активность вещества АmВn, диссоциирующего в водном растворе по уравнению
АmВn «m An+ + n Bm–
равна 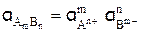 .
.
Для разбавленных растворов слабых электролитов коэффициент активности у = 1 и α = С. Поэтому слабые электролиты подчиняются с достаточной точностью закону действующих масс, и при проведении расчётов в формулу закона действующих масс можно подставлять концентрации ионов.
Для концентрированных растворов слабых кислот следует пользоваться значениями активности ионов, а не концентрациями.
Так, для концентрированного раствора слабой угольной кислоты, в отличие от разбавленного раствора, выражения для константы диссоциации этой кислоты по первой и второй ступеням в растворах, имеющих молярную концентрацию, будет иметь вид:
первая ступень
H2CO3 «H+ + 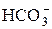 ;
;
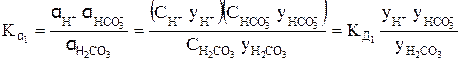
или 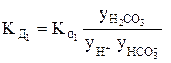 ; (4)
; (4)
вторая ступень
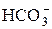 «H+ +
«H+ + 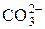 ;
;
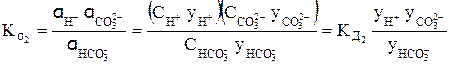
или 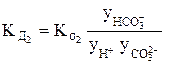 . (5)
. (5)
В выражениях (4) и (5) 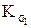 и
и 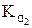 – термодинамические константы диссоциации, которые зависят от температуры и природы растворителя;
– термодинамические константы диссоциации, которые зависят от температуры и природы растворителя; 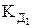 и
и 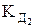 – классические константы диссоциации.
– классические константы диссоциации.
Согласно уравнениям (4) и (5) при уменьшении концентрации ионов в растворе кислоты у ® 1, а Кα приближается к Кд.
Для сильных электролитов g» у» l только в очень разбавленных растворах
(С < 10–4 моль/л) и α» С. При С > 10–4 моль/л коэффициент активности, как правило, меньше единицы. Это значит, что ион стеснён в своих движениях межионными силами, и α < С.
Вычисления величин коэффициентов активности очень сложны. Но для разбавленных растворов коэффициент активности может быть рассчитан по формулам:
lgg = –0,5 Zк Zа 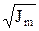 и lg y = –0,5 Zк Za
и lg y = –0,5 Zк Za 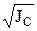 при J £ 0,005 моль/л, (6)
при J £ 0,005 моль/л, (6)
где g и у – средний моляльный и молярный коэффициенты активности;
Zк и Zа – заряд катиона и аниона; Jm и Jc – ионные силы раствора для моляльной и молярной концентраций соответственно.
Ионная сила раствора является мерой напряжённости электрического поля, существующего в растворе, и равна полусумме произведении концентраций всех ионов, присутствующих в растворе на квадрат их заряда:
Jm = 0,5 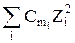 или Jc = 0,5
или Jc = 0,5 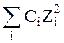 , (7)
, (7)
где Cm и С – моляльная и молярная концентрации соответственно; Zi – заряд иона.
Ионная сила Jm имеет единицу моль/1000 г Н2О или моль/кг Н2О, Jc – моль/л.
В разбавленных растворах электролитов с одинаковой ионной силой коэффициенты активности большинства ионов, имеющих один и тот же заряд, приблизительно одинаковы (см. табл. 1).
Пример 1. Найдите коэффициенты активности ионов Fe3+ и 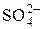 , если ионная сила раствора Fe2(SО4)3 равна 0,0001 моль/л.
, если ионная сила раствора Fe2(SО4)3 равна 0,0001 моль/л.
Пользуясь табл. 1, находим, что при Jc = 0,0001 (10–4) моль/л, коэффициент активности иона Fe3+ равен 0,9, а иона 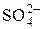 – 0,95.
– 0,95.
Таблица 1
Приближённые значения средних коэффициентов активности
ионов в зависимости от ионной силы раствора
| Ионная сила JС, моль/л | Коэффициент активности у | |||
| Однозарядные ионы | Двухзарядные ионы | Трёхзарядные ионы | Четырёхзарядные ионы | |
| 1×10–4 | 0,99 | 0,95 | 0,90 | 0,83 |
| 1×10–3 | 0,96 | 0,86 | 0,73 | 0,56 |
| 1×10–2 | 0,89 | 0,63 | 0,39 | 0,19 |
| 1×10–1 | 0,78 | 0,33 | 0,08 | 0,01 |
Пример 2. Найдите активность ионов Na+ и Сl– в 0,001 М растворе NaCl. Ионная сила 0,001 М раствора NaCl (см. уравнение 7) равна
Jc = 0,5(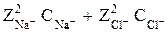 ) = 0,5(12×0,001 + 12×0,001) = 0,001 (10–3) моль/л.
) = 0,5(12×0,001 + 12×0,001) = 0,001 (10–3) моль/л.
Средний коэффициент активности у при ионной силе раствора 10–3 моль/л для однозарядных ионов равен 0,96 (см. табл. 11). Следовательно, активность ионов
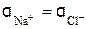 = С у = 0,001×0,96 = 0,00096 моль/л.
= С у = 0,001×0,96 = 0,00096 моль/л.
Пример 3. Найдите активность 0,005 М раствора Al2(SО4)3, если 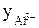 = 0,285, а
= 0,285, а 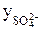 = 0,495.
= 0,495.
Активность раствора Al2(SО4)3 (см, уравнение 3) равна
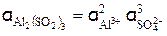 .
.
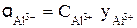 = 0,005×0,285 = 0,01425.
= 0,005×0,285 = 0,01425. 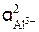 = (1,425×10–2)2 = 2,03×10–4.
= (1,425×10–2)2 = 2,03×10–4.
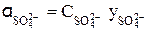 = 0,005×0,495 = 0,02475.
= 0,005×0,495 = 0,02475. 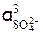 = (2,475×10–2)3 = 1,52×10–5.
= (2,475×10–2)3 = 1,52×10–5.
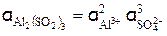 = 2,03×10–4×1,52×10–5 = 3,08×10–9.
= 2,03×10–4×1,52×10–5 = 3,08×10–9.
Пример 4. Найдите ионную силу раствора, содержащего 0,04 моль Рb(NO3)2 и 0,02 моль К2SO4 в 2 л раствора.
Находим содержание количества вещества (моль) Рb(NO3)2 и К2SO4 в 1 л раствора. Это будет 0,02 моль Рb(NO3)2 и 0,01 моль К2SO4. Ионная сила раствора (см. уравнение 7)
Jc = 0,5(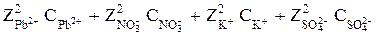 ) =
) =
= 0,5(22×0,02 + 12×0,02 + 12×0,01 + 22×0,01) = 0,09 моль/л.
 2015-06-14
2015-06-14 13475
13475
