Теория электролитической диссоциации неприменима к реакциям, протекающим без участия ионов, например,
NH3(г) + HCl(г) = NH4Cl(тв).
Аммиак NH3, не имея ОН– групп, ведет себя как основание, образуя с НС1 соль NH4Cl.
В 1923 году И.Н. Бренстед и Т.М. Лоури предложили протонную теорию кислот и оснований, применяемую как к водным, так и неводным растворам.
Согласно протонной теории кислоту считают донором протонов (ионов водорода Н+), а основание – акцептором протонов. При взаимодействии кислота отдаёт, а основание принимает протон. Соотношение между кислотой и основанием можно представить схемой

 Н+ Н+
Н+ Н+
кислота1 + основание2 «основание1 + кислота2.
Основание и кислоту, связанные данным соотношением, называют сопряжёнными.
Например,

 Н+ Н+
Н+ Н+
1) HF + NH3 «F– + 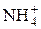 .
.
кислота1 основание2 основание1 кислота2
Кислоте HF соответствует сопряжённое основание F– (пара HF/F–), а основанию NH3 соответствует сопряжённая кислота 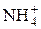 (пара NH3/
(пара NH3/ 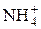 ). В зависимости от партнера одно и то же вещество может быть или кислотой или основанием. Такие вещества называются амфолитами.
). В зависимости от партнера одно и то же вещество может быть или кислотой или основанием. Такие вещества называются амфолитами.
Например,

 Н+ Н+
Н+ Н+
1) H2О + NH3 «OH– + NH4+.
кислота1 основание2 основание1 кислота2
Сопряженные пары: для кислоты Н2О/ОН-; для основания NH3/NH4+.

 Н+ Н+
Н+ Н+
2) H2О + HF «H3O+ + F–.
oснование1 кислота2 кислота1 основание2
Сопряженные пары: для основания H2О/H3O+; для кислоты HF/F–.
Кислотно-основные свойства, согласно протонной теории, количественно характеризуются протонным сродством, или энергией, которая выделяется при присоединении протона к молекуле или иону. Роль основания играет тот партнер, у которого протонное сродство наибольшее.
В первом случае протонное сродство у NH3 больше, чем у H2О, поэтому NH3 – основание. Во втором случае у H2О протонное сродство больше, чем у HF, следовательно, H2О – основание.
Таким образом, по теории Бренстеда кислотой является всякая частица (молекула, ион), отдающая протон. Основание – всякая частица (молекула, ион), принимающая протон.
Вещества, проявляющие кислотные и основные свойства, называются протолитами.
Согласно протонной теории кислоты делятся на три группы.
Первая группа – нейтральные кислоты:
H2SО4 «Н+ + 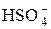 ;
;
кислота основание
Вторая группа – анионные кислоты:
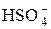 «Н+ +
«Н+ + 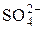 .
.
кислота основание
Третья группа – катионные кислоты:
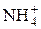 «NH3 + Н+.
«NH3 + Н+.
кислота основание
К числу катионных кислот относятся гидратированные катионы многозарядных металлов
[Al(H2O)6]3+ «[Al(H2O)5OH]2+ + H+.
кислота основание
Аналогичная классификация для оснований.
Первая группа – нейтральные основания: H2O, NH3, C6H5NH2 и др.
Вторая группа – анионные основания: Сl–, 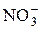 , ОН– и др.
, ОН– и др.
Третья группа – катионные основания: H2N- 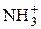 и др.
и др.
Анионы многоосновных кислот являются амфолитами. Например,
1) Н3РO4 «Н+ + 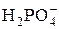 ;
;
кислота основание
2) 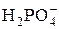 «Н+ +
«Н+ + 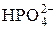 ;
;
кислота основание
3) 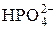 «Н+ +
«Н+ + 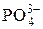 .
.
кислота основание
Большинство соединений, обладающих кислотной или основной функцией в водном растворе, обратимо реагируют с водой и являются слабыми протолитами. Состояние протолитического равновесия с участием слабой кислоты (молекула, ион) в разбавленном растворе
HCN + Н2О «CN– + H3O+
кислота основание
количественно характеризуется константой кислотности
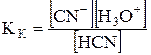 = f (t) = 4,93×10–10 моль/л (25 °С).
= f (t) = 4,93×10–10 моль/л (25 °С).
Чем больше значение Кк, тем сильнее кислота. Например, из двух слабых кислот Н3РO4 и H2S, которым отвечают уравнения реакций протолиза
Н3РO4 + Н2О «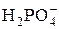 + H3O+; Кк = 7,24×10–3 (25 °С);
+ H3O+; Кк = 7,24×10–3 (25 °С);
H2S + H2O «HS– + H3O+; Кк = 1,05×10–7 (25°С).
более сильным протолитом с кислотной функцией является Н3РO4.
Состояние протолитического равновесия с участием слабого основания (молекула, ион) в разбавленном растворе
NH3 + Н2О «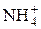 + ОН–.
+ ОН–.
основание кислота
количественно характеризуется константой основности
 = f (t) = 1,74×10–5 моль/л (25 °С).
= f (t) = 1,74×10–5 моль/л (25 °С).
Для каждой сопряженной кислотно-основной пары, например, HCN/CN– значения Кк и Ко связаны соотношением
КВ = КК КО = f (t),
КВ – ионное произведение воды, равное 10–14 при 25 °С.
Поэтому, зная Кв и Кк, можно рассчитать Ко. В справочной литературе приводятся только значения констант кислотности.
 2015-06-14
2015-06-14 3014
3014







