Если раствор отделен от чистого растворителя полупроницаемой мембраной, не пропускающей растворенное вещество, возникает односторонняя диффузия молекул растворителя в раствор, называемая осмосом.
 Причиной осмоса является хаотическое движение частиц. Осмос является процессом самопроизвольным.
Причиной осмоса является хаотическое движение частиц. Осмос является процессом самопроизвольным.
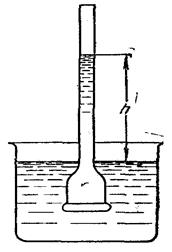
Представим себе два сосуда, расположенных один в другом (рис.). При этом пусть дно внутреннего сосуда сделано из материала (полупроницаемого материала), сквозь который проходит растворитель, но не может проходить растворенное вещество. Наружный сосуд наполним водой, а во внутренний поместим водный раствор, например сахара. Вода через полупроницаемую мембрану начинает поступать в сосуд.
Переход растворителя в раствор будет происходить до тех пор, пока постоянно возрастающее гидростатическое давление (высота столба h) раствора не воспрепятствует ему. Это давление называется осмотическим давлением.
Осмотическое давление – давление, которое нужно приложить к раствору, чтобы привести его в равновесие с чистым растворителем, отделенным от раствора полупроницаемой мембраной.
|
|
|
Осмотическое давление π достаточно разбавленных растворов может быть найдено по уравнению Вант-Гоффа:
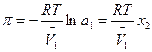
где а1 – активность растворителя (≈ х1), х2 – мольная доля растворенного вещества,
V1 – мольный объем растворителя.
В разбавленных растворах это выражение преобразуется в уравнение Вант-Гоффа:
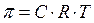
где С – молярная концентрация растворенного вещества;
Т — абсолютная температура.
Осмотическое давление тем больше, чем больше концентрация растворенного вещества и чем выше температура.
 2015-06-14
2015-06-14 551
551








