ФАЗОВЫЕ СОСТОЯНИЯ УГЛЕВОДОРОДНЫХ СИСТЕМ
(Требин, Макогон, Басниев, 1976)
Природные газы представляют собой смеси отдельных газов. Каждый из этих газов называется компонентом, т. е. добываемые природные газы являются многокомпонентными системами.
Отдельный газ или многокомпонентная система могут находиться в одно-, двух- и трехфазном состоянии. Газы в зависимости от условий и свойств вещества могут быть в газообразном, жидком или твердом состоянии.
Фазовые превращения систем природных углеводородов в значительной степени определяют физические явления, присущие процессам разработки и эксплуатации месторождений нефти и газа. Знание закономерностей фазовых превращений и умение их прогнозировать позволяют развивать методы повышения нефте- и конденсатоотдачи пластов, проектировать эффективные технологические схемы промысловой обработки, заводской переработки и транспортировки добываемого сырья. (ББЗ, 1992)
Фазовое состояние вещества при заданных параметрах зависит от числа компонентов, входящих в систему. Последовательно рассмотрим фазовые состояния одно-, двух- и многокомпонентных систем.
Однокомпонентные системы
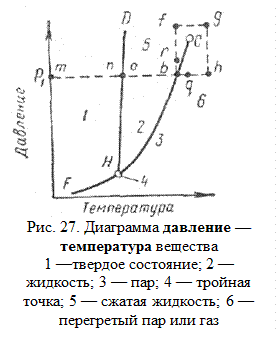
Если вещество находится в однофазном состоянии, то его объем V определяют по температуре Т и давлению р. Фазовое состояние вещества на рис. 26 изображено поверхностями среза. Однако такими пространственными диаграммами пользоваться сложно. Поэтому при изучении фазового состояния компонентов природного газа используют графики зависимости давление — температура (рис. 27) при постоянном объеме и объем — давление при постоянной температуре (рис. 28).
Условия, при которых вещество одновременно может существовать в газообразном и в жидком состоянии, выделены площадью HbCdl (рис. 26). Линии, проведенные внутри этой площади, параллельны плоскости основания диаграммы, поэтому проекции линий СbН или Cdl на плоскость с показателями давление — температура сходятся в одну кривую НС (рис. 27), известную как кривая давления насыщенного пара.
Для определения числа фаз и их состава достаточно знать только температуру (согласно правилу фаз) при заданном давлении.
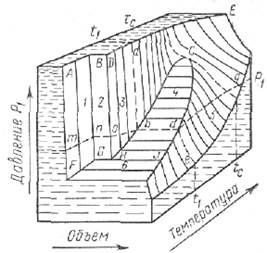
Рис. 26. Пространственная диаграмма давление — объем — температура состояния вещества
1 — твердое состояние; 2 — твердое состояние + жидкость; 3 — жидкость; 4 — жидкость + пар; 5 — пар; 6 — твердое состояние + пар; t1—t2; tс—tс; р1—р1 — линии температур и давлений, ограничивающих области состояния вещества
Кривая давления насыщенных паров в зависимости от температуры (рис. 26, 27) определяет равновесное состояние паровой и жидкой фаз (участок НС) и паровой и твердой фаз (участок FH). Точка С является критической для данного компонента, а температура и давление, соответствующие этой точке, называются критическими. Кривая HD – кривая температур плавления - разделяет области существования твердой и жидкой фаз. Обычно эта кривая наклонена вправо (исключением является вода, температура замерзания которой понижается с увеличением давления). При изобарном повышении температуры от точки m до точки n вещество переходит из твердого в жидкое (в точке n), и из жидкого в парообразное (точка b).
 Рассмотрим диаграмму объем — давление при заданной температуре и проследим изменение состояния однокомпонентной системы при изменении объема в изотермическом процессе (рис.28). При уменьшении объема давление в системе возрастает по кривой АВ. В точке А вся система находится в однородном паровом состоянии, в точке В давление равно давлению насыщенных паров, т. е. в этой точке начинается конденсация пара (точка росы). Дальнейшее снижение объема приводит к дополнительной конденсации пара при постоянных температуре и давлении. Конденсация заканчивается в точке С (точка насыщения), после чего снижение объема системы сопровождается резким повышением давления по кривой CD, так как происходит сжатие жидкости. Однокомпонентная система характерна постоянством давления в точке росы и в точке насыщения (испарения).
Рассмотрим диаграмму объем — давление при заданной температуре и проследим изменение состояния однокомпонентной системы при изменении объема в изотермическом процессе (рис.28). При уменьшении объема давление в системе возрастает по кривой АВ. В точке А вся система находится в однородном паровом состоянии, в точке В давление равно давлению насыщенных паров, т. е. в этой точке начинается конденсация пара (точка росы). Дальнейшее снижение объема приводит к дополнительной конденсации пара при постоянных температуре и давлении. Конденсация заканчивается в точке С (точка насыщения), после чего снижение объема системы сопровождается резким повышением давления по кривой CD, так как происходит сжатие жидкости. Однокомпонентная система характерна постоянством давления в точке росы и в точке насыщения (испарения).
Критическая точка соответствует месту пересечения линии точек росы с линией точек кипения. Известно, что в критической точке жидкость и пар имеют одинаковые свойства.
Обычно зависимость давление — объем для вещества изображается при различных изотермах, например для метана (рис. 29).
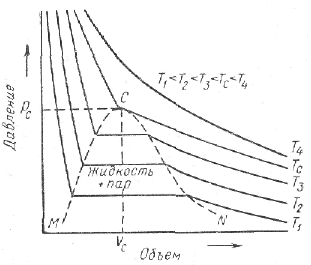 Рис. 28. Диаграмма давление — объем для однокомпонентной системы
Рис. 28. Диаграмма давление — объем для однокомпонентной системы
|
 2015-07-04
2015-07-04 1189
1189







