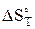 =
= 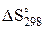 + DСр × ln
+ DСр × ln 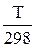 (41)
(41)
если DСр – const, т.е. не зависит от температур.
3. ОСНОВНЫЕ ФРАГМЕНТЫ ПО ТЕМЕ “ХИМИЧЕСКОЕ РАВНОВЕСИЕ. КОНСТАНТА РАВНОВЕСИЯ”
Для состояния химического равновесия химической реакции
aA + bB = cC + dD
характерно, что:
а) скорость реакции равна нулю (т.е. скорости прямого и обратного процессов равны);
б) 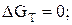
в) в системе устанавливаются такие равновесные активности реагирующих веществ, что отношение:
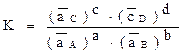 (42)
(42)
представляет собой константу К, зависящую только от температуры. Величину К называют константой равновесия химической реакции, а величины 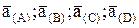 - активностями соответствующих веществ в состоянии равновесия.
- активностями соответствующих веществ в состоянии равновесия.
Активность чистого конденсированного (жидкое, твердое) вещества максимальна и равна единице.
Активность газообразного вещества равна парциальному давлению газа в смеси газов (рг).
Активность вещества в растворе равна коэффициенту активности, умноженному на процентную массовую концентрацию вещества аi = fi [%i]
Константа равновесия химической реакции (К) связана с стандартным химическим сродством формулой
|
|
|
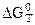 = -RT lnK, (43)
= -RT lnK, (43)
где R – газовая постоянная (R = 8,31 Дж/(моль × К))
исходя из этого, рассчитав 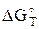 по формуле
по формуле
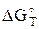 =
= 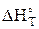 –
– 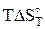 , (44)
, (44)
можно найти значение константы равновесия при заданной температуре.
К = 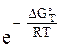 (45)
(45)
Термодинамические величины простых веществ и химических соединений (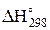 ,
, 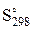 ) приведены в таблице приложения.
) приведены в таблице приложения.
Задача:
1) Выразить константу равновесия химической реакции
6Fe2O3 (чист. кр.) = 4Fe3O4 (чист.кр.) + O2 (газ)
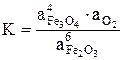
так как 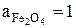 ,
, 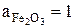 (кристал.чистые вещества, взаимно не растворимы),
(кристал.чистые вещества, взаимно не растворимы), 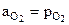 , то
, то 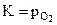 .
.
2) Используя термодинамические величины, вычислить константу равновесия реакции при Т = 2000 К.
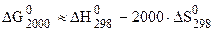
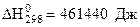
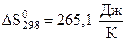

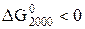 , прямая реакция при Т = 2000 К возможна
, прямая реакция при Т = 2000 К возможна
3) Находим константу равновесия
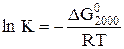
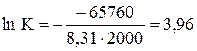
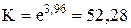 .
.
 2015-07-03
2015-07-03 390
390








