Раніше (див. кн. 2, с 447) були розглянуті загальні методи добування амінокислот, в т.ч. α-амінокислот. В процесі синтезу утворюється рацемічна суміш (±)-α-амінокислот, розділення котрої на оптичні антиподи проводять за допомогою хімічних і ферментативних методів (див. кн. 1, с 83).
Найширше використовуваний, хімічний метод розщеплення рацематів α-амінокислот ґрунтується на утворенні діастереомерних солей N-ацильних похідних (±)-α-амінокислот з оптично активними основами, наприклад, бруцином або стрихніном. Внаслідок різної розчинності один з діастереомерів утворює осад, а інший, більш розчинний, залишається у розчині. Розділені діастереомерні солі потім розкладають до α-амінокислот.
Ферментативний метод розщеплення оснований на гідролізі N-ацил-α-амінокислот ацилазами або складних ефірів α-амінокислот – естеразами.
Гідроліз білків. α-Амінокислоти добувають шляхом лужного, кислотного або ферментативного гідролізу білків. При кислотному гідролізі відбуваються також побічні реакції, наприклад, глутамін і аспарагін гідролізуються до глутамінової та аспарагінової кислот, а триптофан розкладається. Лужний гідроліз призводить до рацемізації α-амінокислот. Тому найширше застосовується ферментативний метод гідролізу. Розділення α-амінокислот у білкових гідролізатах проводять за допомогою іонообмінної хроматографії.
Мікробіологічний синтез. Деякі мікроорганізми в процесі своєї життєдіяльності виробляють певні α-амінокислоти. Ці мікроорганізми вирощують на багатих вуглеводами середовищах— крохмалі, меласі, патоці та ін. Таким способом добувають аспарагінову та глутамінову кислоти, триптофан, лізин та ін.
6.1.4. Хімічні властивості α-амінокислот
Раніше (див. кн. 2, с 448) були розглянуті хімічні властивості амінокислот. В цьому ж розділі подані реакції, котрі застосовуються в аналізі α-амінокислот, синтезі пептидів або лежать в основі перетворень α-амінокислот в організмі.
А. Реакції по аміногрупі
Утворення N-ацильних похідних. При взаємодії α-амінокислот з ангідридами або хлорангідридами карбонових кислот утворюються N-ацильні похідні, котрі відносно легко руйнуються до вихідних а-амінокислот. У зв'язку з цим реакція ацилювання використовується для блокування (захисту) аміногрупи при синтезі пептидів. Як ацилюючі реагенти використовують бензоксикарбонілхлорид (а) або трет -бутоксикарбоксазид (б):
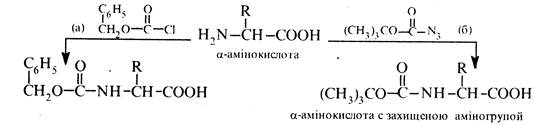
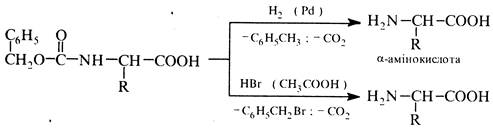
Захисну карбобензоксигрупу видаляють каталітичним гідрогенолізом або дією розчину бромоводню в оцтовій кислоті на холоді:
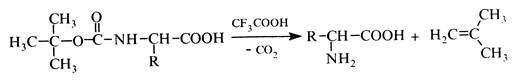
Трет -бутоксикарбонільну групу руйнують дією трифтороцтової кислоти:
Дезамінування. Під дією азотистої кислоти α-амінокислоти перетворюються на відповідні α-гідроксикислоти:
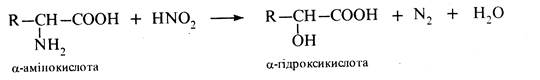
Реакція застосовується в аналітичній практиці (метод Ван-Слайка).За об'ємом азоту, що виділився, визначають кількісний вміст α-амінокислоти.
В організмі α-амінокислоти піддаються окисному дезамінуванню. Реакція відбувається під дією ферментів оксидаз і окисного агенту коферменту НАД+:

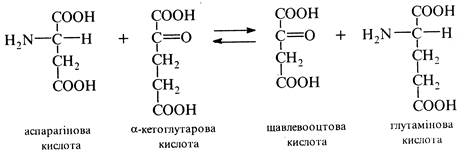
Трансамінування (переамінування). Процес проходить тільки в живих організмах. Реакція відбувається за участю ферментів транс-аміназ і коферменту піридоксальфосфату між α-аміно- і α-кетокислотами та зводиться до взаємообміну аміно- та карбонільною групами:
Взаємодія з карбонільними сполуками. Формальдегід реагує з α-амінокислотами у водному розчині з утворенням N-гідроксиметильних похідних.
Реакцію покладено в основу кількісного визначення α-амінокислот методом формольного титрування за Серенсеном.
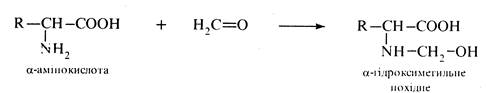
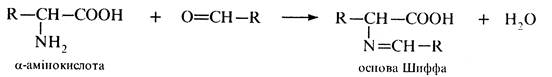
Інші альдегіди та кетони реагують з α-амінокислотами з утворенням основ Шиффа:
Взаємодія з фенілізотіоціанатом (реакція Едмана). При взаємодії а-амінокислот з фенілізотіоціанатом утворюються похідні З-феніл-2-тіогідантоїну. Спочатку в присутності лугу відбувається приєднання фенілізотіоціанату за аміногрупою α-амінокислоти, а потім при нагріванні продукту приєднання в присутності мінеральної кислоти відбувається циклізація з утворенням похідного фенілтіогідантоїну (ФТГ-похідного):
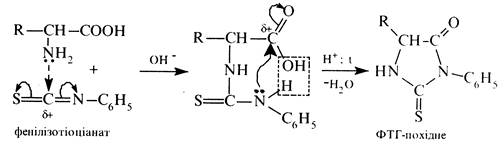
Реакція використовується для установлення будови пептидів (деградація за Едманом).
Взаємодія з 2,4-динітрофторбензолом (реактив Сетера). При
взаємодії α-амінокислот з 2,4-динітрофторбензолом (ДНФБ) утворюється N-динітрофенільне похідне (ДНФ-похідне):
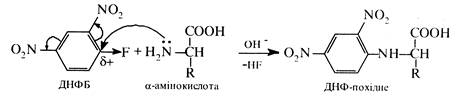
Реакція проходить за механізмом SN (див. кн. 2, с. 176). Використовується для визначення будови пептидів.
Б. Реакції по карбоксильній групі
Утворення хелатних сполук. Характерною особливістю α-амінокислот є здатність утворювати міцні хелати комплексні солі з іонами важких металів, наприклад:
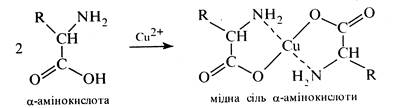
Незначна розчинність та інтенсивне забарвлення хелатів міді (II) дозволяє використовувати їх в аналітичній практиці для виявлення α-амінокислот.
Утворення складних ефірів. Яккарбонові кислоти α-амінокислоти при взаємодії зі спиртами утворюють складні ефіри:
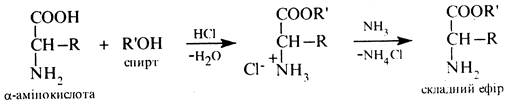
Складні ефіри α-амінокислот розчинні в органічних розчинниках, леткі та добре переганяються. Ці властивості їх використовуються при розділенні суміші α-амінокислот у білкових гідролізатах. З цією метою α-амінокислоти спочатку етерифікують, а потім одержані ефіри піддають перегонці. Для розділення суміші складних ефірів α-амінокислот нині застосовують метод газорідинної хроматографії (ГРХ). Ця реакція служить також зручним методом захисту карбоксильної групи при синтезі пептидів.
Утворення галогенангідридів і ангідридів. Аналогічно карбоновим кислотам, α-амінокислоти утворюють галогенангідриди та ангідриди (див. кн. 2, с 360). Перед проведенням реакції спочатку захищають аміногрупу утворенням N-ацильних похідних.
Декарбоксилювання. У зв'язку з наявністю біля α-вуглецевого атома двох сильних електроноакцепторних груп – карбоксильної та аміногрупи α-амінокислоти відносно легко декарбоксилюються:
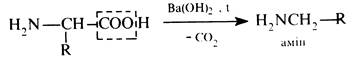
 2015-07-14
2015-07-14 2418
2418








