Зависимость скорости реакции от концентрации реагентов выражается законом действующих масс: скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степень их стехиометрических коэффициентов.
mA+nB=AmBn
Vпр = kпрC(A)m*C(B)n Vобр= kобрС(AmBn)
Где k – константа скорости реакции. Численно k равна скорости данной реакции при концентрации веществ, равных 1 моль/л. k= constдля данной реакции. k = 10-8 – 10-1 – медленные реакции; k=101 – 1011 – быстрые реакции.
Уравнение, связывающее скорость химической реакции с концентрацией вещества называется кинетическим уравнением.
Сумма показателей степени (n+m) называется порядком реакции (n).
Порядок реакции зависит от ее сложности. Если реакция простая, т.е. протекает в одну стадию, то порядок реакции равен сумме стехиометрических коэффициентов.
Закон действующих масс для прямой гомогенной реакции,
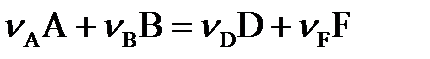
протекающей слева направо в однородной среде (смесь газов, раствор) (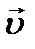 ), имеет вид:
), имеет вид:
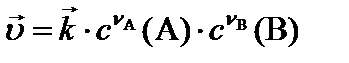
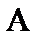 ,
, 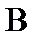 – реагенты – вещества, вступающие в реакцию;
– реагенты – вещества, вступающие в реакцию;
|
|
|
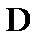 ,
, 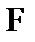 – продукты – вещества, образующиеся в результате реакции;
– продукты – вещества, образующиеся в результате реакции;
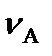 ,
, 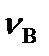 ,
, 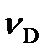 ,
, 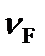 – стехиометрические коэффициенты, показывающие, какое количество соответствующего вещества участвует в реакции.
– стехиометрические коэффициенты, показывающие, какое количество соответствующего вещества участвует в реакции.
Для гетерогенной реакции, протекающей на границе раздела фаз (твердой и жидкой, твердой и газообразной) концентрации веществ, находящихся в конденсированном состоянии, постоянны и включаются в константу скорости реакции. Тогда для прямой реакции
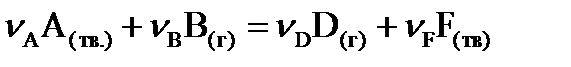 ,
,
если вещество 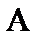 твердое, закон действующих масс запишется:
твердое, закон действующих масс запишется:
Для обратимых химических реакций, которые могут протекать как в прямом, так и в обратном направлениях, скорости реакции запишутся:
| Вид реакции | скорость реакции | |
прямой (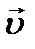 ) )
| обратной (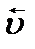 ) )
| |
| Гомогенная | 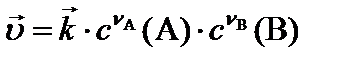
| 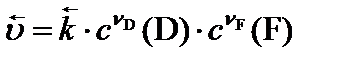
|
Гетерогенная: вещества 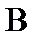 и и 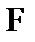 твердые или жидкие твердые или жидкие
| 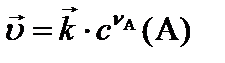
| 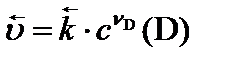
|
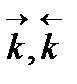 – константы скоростей прямой и обратной реакций, соответственно. Физический смысл константы скорости: при концентрации всех реагирующих веществ, равных 1 моль/л, константа скорости равна скорости реакции.
– константы скоростей прямой и обратной реакций, соответственно. Физический смысл константы скорости: при концентрации всех реагирующих веществ, равных 1 моль/л, константа скорости равна скорости реакции.
Константа скорости реакции зависит от природы реагирующих веществ, температуры и присутствия катализатора. Для каждой реакции при постоянной температуре константа скорости величина постоянная.
Используя закон действующих масс, можно определить, как будет изменяться скорость реакции при изменении параметров системы: 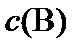 ,
, 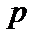 ,
, 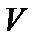 .
.
 2015-08-21
2015-08-21 1448
1448








