
11). Обратимые и необратимые химические реакции:
Реакции, которые в любых условиях самопроизвольно протекают в одном направлении, называются необратимыми
2KClO 3 = 2KCl + 3O 2 ↑
Реакции, которые при одной и той же температуре, в зависимости от соотношения реагентов могут протекать, как в прямом, так и в обратном направлении, называются обратимыми. Знак равенства в уравнении меняется на ⇌
3H2 + N2 ⇌ 2NH3.
Большинство химических реакций является обратимыми.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ – состояние химической системы, при котором возможны реакции, идущие с равными скоростями в противоположных направлениях. При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем.
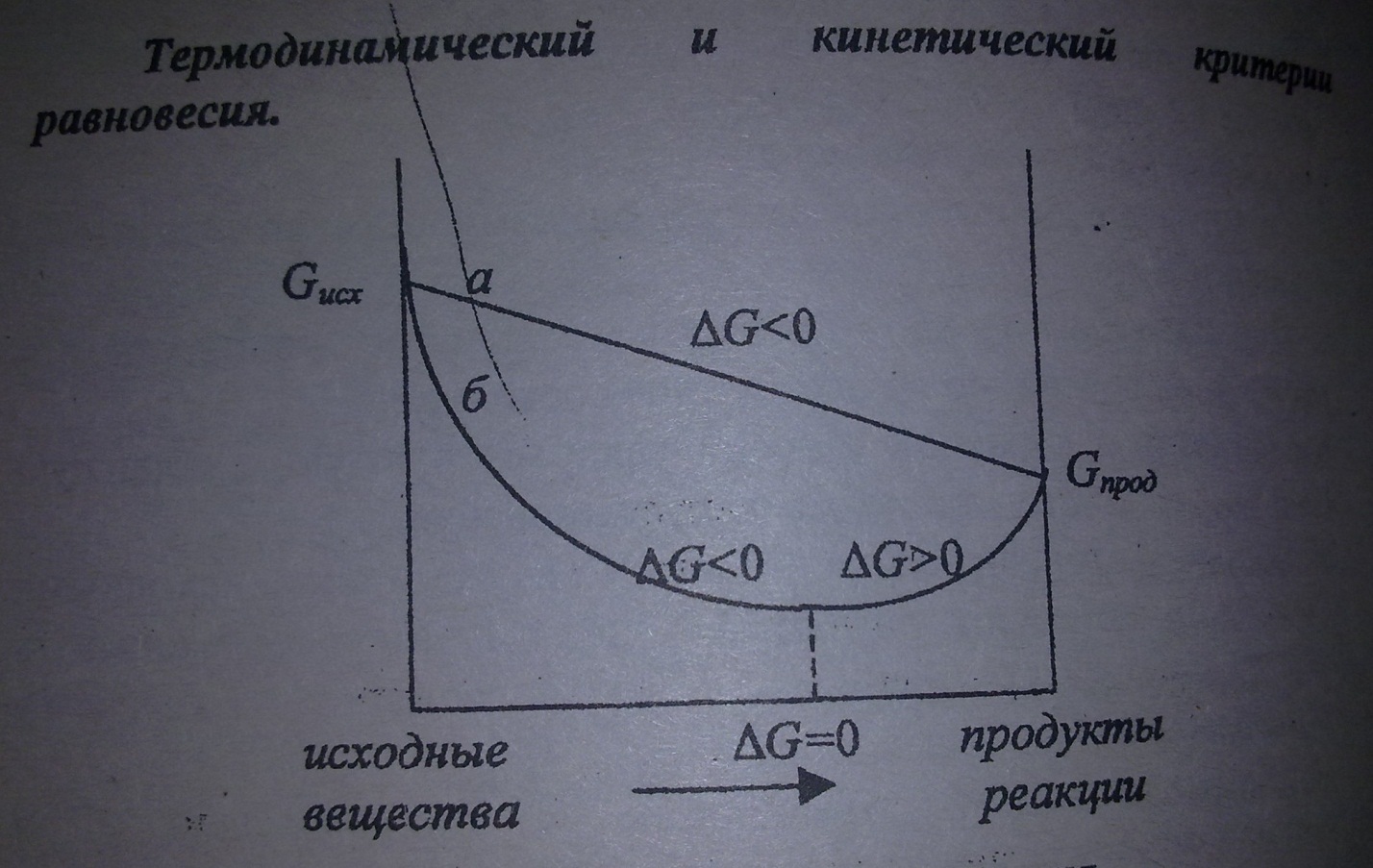
12). Константа химического равновесия — количественная характеристика химического равновесия
Константа химического равновесия определяется по закону действующих масс. Ее значения находят расчетно или на основании экспериментальных данных. Константа химического равновесия зависит от природы реагентов и от температуры.
|
|
|
Гетерогенная реакция (для газов):
Кс=[D]m/[A]n*[B]m
2ZnS(тв)+3O2(г) ⇌2ZnO(тв)+2SO2(г)
Кс=[SO2]2m/[O2]3
Гомогенная реакция:
Kc=[C]n*[D]m/[A]n*[B]m
Парциа́льное давление)— давление отдельно взятого компонента газовой
Смеси
Кр=рm(С)*рn(D)/ pm(A)*pn(B)
Pобщ=сумма Pi
Pi=CiRT- уравн-ие Клаперона-Менделеева
Pi-парциальное давление
Kp=Kc(RT)∆V
∆V=C+d-a-b
C+d=a+b => Kc=Kp
13) Связь Кс и свободной энергии Гиббса:
∆G0p=-RTlnKp
Kp=ln-∆ Gp/RT
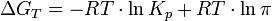
Это уравнение называют уравнением изотермы химической реакции. Оно позволяет рассчитать изменение энергии Гиббса при протекании процесса и определить направление протекания реакции:
при 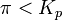
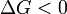 — реакция идёт в прямом направлении, слева направо;
— реакция идёт в прямом направлении, слева направо;
при 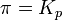
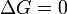 — реакция достигла равновесного состояния;
— реакция достигла равновесного состояния;
при 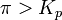
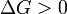 — реакция идёт в обратном направлении.
— реакция идёт в обратном направлении.
Влияние Т на К равновесия:
∆G0p=-RTlnKp
lnKp=-∆G0p/RT=-∆H0p/RT+∆S0p/R
Для экзотермической реакции (∆H<0), константа равновесия уменьшается с повышением температуры
Для экзотермической реакции (∆H>0), константа равновессия повышается с повышением температуры
14) Смещение химического равновесия
Хим. Равновесие можно сместить, если непрерывно выводить из реакционной смеси продукты реакции за счёт образования осадка или выделения газа
Принцып Ле-Шателье: если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо внешнее воздействие, то равновесия сместится так, чтобы уменьшить эффект оказываемого воздействия.
Влияние температуры:
Повышение температуры вызывает смещение равновесия в том в направлении эндотермической реакции. Напротив, понижение температуры способствует протеканию экзотермической реакции.
|
|
|
Влияние давления:
Повышение давления смещает равновесие в направлении реакции, которая ведёт к уменьшению объёма системы.
Влияние концетраций:
Равновесие сместится в направлении прямой реакции (в сторону образования продукта).
Влияние катализатора:
Не влияет на Кс, т.к. в одинаковой степени ускоряет и прямую и обратную реакции.
 2015-08-21
2015-08-21 1374
1374







