| Обратимое
| Необратимое
|
| Ингибиторы не вносят в молекулу фермента каких-либо изменений после своей диссоциации
| Ингибиторы ферментов необратимо модифицируют целевой фермент
|
По механизму действия:
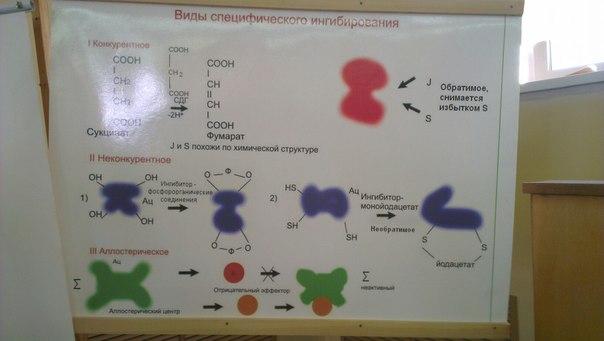
| Конкурентное
| Неконкурентное
| Ингибирование отсутствует
| Аллостерическое
|
| Вызывается веществами имеющими структуру, похожую на структуру субстрата А. Основано на связывании ингибитора с субстрат-связывающим центром
| Вызывается веществами не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте фермента
| Ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с ферментом, изменяет его конформацию, что делает возможным связывание с ингибитором. Ингибитор, в свою очередь, так меняет конформацию фермента, что катализ становится невозможным
| Ингибиторы действуют на аллостерический центр ферментов, вызывая изменения в структуре активного центра. В результате меняется способность субстрата связываться с ферментом
|
| Пример: торможение СДГ малоновой кислотой
| Действие йод-ацетата, ДФФ, солей синильной кислоты
|
| Синильная кислота (цианиды) связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание
|
| 5. Методы определения активности ферментов. Принцип количественного определения ферментов. Единицы активности
| Характеристикой активности ферментов является скорость, с которой они катализируют ту или иную реакцию. Она измеряется скоростью превращения субстрата или скоростью накопления продуктов реакции. Измерять нужно начальную скорость превращения, а не количество субстрата, превращенного за определенный отрезок времени.
Комиссия по ферментам Международного биохимического союза дает понятие о стандартной единице активности. Единица активности (Е) – это количество фермента, которое катализирует превращение одного микромоля субстрата в мин при стандартных условиях (в оптимуме рН, при избытке субстрата, температуре 37 или 20º С).
Для определения ферментативной активности используют следующие методы:
1. Химический метод – количественное определение субстрата или продуктов с помощью химических реагентов (О-гликозилгидролазы – по образованию восстанавливающих сахаров).
2. Спектрофотометрический метод – измерение скорости ферментативной реакции по изменению поглощения субстрата при характеристической длине волны (лиазы – по образованию двойной связи).
3. Манометрический метод – определение количества газа, выделяющегося в процессе реакции (оксидазы – по поглощению О2, декарбоксилазы – по выделению СО2).
4. Поляриметрический метод – фиксируется изменение оптического вращения (β-фруктофуранозидаза).
5. Хроматографический – количественное определение субстрата или продуктов с помощью различных видов хроматографии: бумажной (анализ сахаров), тонкослойной (гликозидов со сложными агликонами), ВЭЖХ (аминокислотный анализ и др.).
Удельная активность – это число единиц активности (Е) на мг белка.
|
| 6. Регуляция активности ферментов
| Одним из уникальных свойств живых организмов является удивительная их способность к сохранению сбалансированности катаболических (биодегра-дативных) и анаболических (биосинтетических) процессов. При этом в клетках одновременно совершаются процессы синтеза, распада и взаимопревращения сотен и тысяч разнообразных веществ, которые в свою очередь регулируются множеством механизмов, обеспечивающих постоянство внутренней среды организма.
· Влияние закона действия масс.
В катализируемой ферментом обратимой химической реакции, например А + В <=> С + D, концентрация компонентов реакции и соответственно направление реакции будут регулироваться влиянием закона действия масс.
Оно может быть показано в обратимой реакции трансаминирования, катализируемой ферментом аланинаминотрансферазой: Аланин + α-Кетоглутарат <=> Пируват + Глутамат. Этот тип регуляции играет лишь ограниченную роль, поскольку в реальных условиях реакция обычно протекает в одном направлении, так как образовавшиеся продукты могут оказаться субстратами для действия других ферментов и выводиться из сферы реакции. В этих случаях устанавливается скорее устойчивое (стационарное) состояние, чем истинное равновесие.
· Изменение количества фермента.
На бактериях изучен феномен индуцированного (индуцирующего) синтеза ферментов при выращивании их на среде, где единственным источником углерода и энергии служит тот или иной углевод, например глюкоза. Замена в средеглюкозына лактозу (индуктор)приводит к индуцированному или адаптивному (после небольшого периода лаг-фазы) синтезу ферментагалактозидазы, расщепляющей лактозу на глюкозу и галактозу.
В клетках прокариот и эукариот имеются ферменты, концентрация которых не требует добавления индуктора; это так называемые конститутивные ферменты. Количество фермента в клетке зависит от наличия продукта реакции, катализируемой данным ферментом, причем продукт реакции вызывает торможение синтеза фермента в результате репрессии. При поступлении в организм некоторых ядов, канцерогенных веществ, алкалоидов, инсектицидов через несколько дней наблюдается резкое повышение активности (соответственно количества) ферментов-гидроксилаз (монооксигеназ) эндоплазматической сети клеток печени, окисляющих чужеродные вещества в нетоксичные для организма продукты. Вполне допустимо предположить, что в этих случаях имеет место синтез ферментов путем индукции (т.е. de novo). Описаны случаи, когда под действием подобных гидроксилаз чужеродные вещества превращаются в организме в более токсичные соединения. Это явление, обратное детоксикации, получило название летального синтеза.
· Проферменты.
Протеолитические ферменты пищеварительного тракта, а также поджелудочной железы синтезируются в неактивной форме –в видепроферментов (зимогенов). Регуляция в этих случаях сводится к превращению проферментов в активные ферменты под влиянием специфических агентов или других ферментов – протеиназ. Так, трипсин в поджелудочной железе синтезируется в форме неактивного трипсиногена. Поступив в кишечник, он превращается в активный трипсин в результате аутокатализа или под действием других протеиназ. Превращение неактивного пепсиногена в активный пепсин происходит аутокаталитически в результате специфического ограниченного протеолиза в присутствии соляной кислоты и также связано с отщеплением от профермента специфического ингибитора пептидной природы.
Эти превращения зимогенов в активные ферменты связаны с конформационными изменениями молекулы фермента и формированием активного центра или его раскрытием (демаскирование). Синтез протеиназ в неактивной форме и ряда других неактивных белков-предшественников имеет биологический смысл, предотвращая разрушение клеток органов, в которых образуются проферменты. Примерами подобного активирования белков является активирование некоторых гормонов (проинсулин —> инсулин), белка соединительной ткани (растворимый проколлаген превращается в нерастворимый коллаген), белков свертывающей системы крови.
· Химическая модификация фермента.
Некоторые белки при формировании третичной структуры подвергаются постсинтетической химической модификации. Оказалось, что активность ряда ключевых ферментов обмена углеводов, в частности фосфорилазы, гликогенсинтазы и др., также контролируется путем фосфорилирования и дефосфорилирования, осуществляемого специфическими ферментами – протеинкиназой и протеинфосфатазой, активность которых в свою очередь регулируется гормонами. Уровень активности ключевых ферментов обмена углеводов и соответственно интенсивность и направленность самих процессов обмена определяются соотношением фосфорилированных и дефосфорилированных форм этих ферментов. Обычно различают обратимую ковалентную и нековалентную химические модификации ферментов, осуществляемые через ОН-группы серина, реже – тирозина или за счет нековалентных взаимодействий с молекулой фермента. В первом случае активным ферментом оказывается или фосфорилированная, или дефосфорилированная форма, как в случае с молекулами мышечной фосфорилазы и гликогенсинтазы соответственно. В качестве примеров можно в виде схемы представить оба типа модификации, в которой символом Р обозначается остаток фосфата, Pi– неорганический фосфат (Н3РО4), РРi – неорганический пирофосфат (Н4Р2О7), АМФ – остаток адениловой кислоты
Химическая постсинтетическая модификация ферментов включает, кроме того, процессы ограниченного протеолиза, метилирования, гликозилирования, уридилирования, аденилирования, АДФ-рибозилирования и др., обеспечивая тем самым микроскопический тип регуляции активности ферментов и соответственно физиологическую скорость процессов обмена веществ.
· Аллостерическая регуляция.
Во многих строго биосинтетических реакциях основным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи. Это означает, что конечный продукт биосинтетической цепи подавляет активность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепи реакции. Поскольку конечный продукт структурно отличается от субстрата, он связывается с аллостерическим (некаталитическим) центром молекулы фермента, вызывая ингибирование всей цепи синтетической реакции.
|
| 7. Применение ферментов и ингибиторов в медицине
| | Ингибиторы ферментов
| | 1) Протеолиза
| | Пантрипин, Ингитрил, Контрикал, Гордокс
| Снижают активность трипсина, химотрипсина, каллекреина, плазмина. Применяют для лечения острого панкреатита, хронического панкреатита, панкреонекроза
| | 2) Холинэстеразы
| | Прозерин, Фазостигмин, Галантамин
| Инактивируют холинэстеразу, приводят к накоплению ацетилхолина. Применяют при миастении, мышечной дистрофии, для сужения зрачка, снижения внутриглазного давления при глаукоме.
| | 3) Карбоангидразы
| | Дикарб
| Угнетает образование угольной кислоты, увеличивает выделение с мочой Na+, HCO3-, воды. Диуретическое средство.
| | 4) Фибринолиза
| | Кислота амино-капроновая
| Угнетает действие плазмина. Применяют для остановки кровотечений при хирургических вмешательствах, различных патологических состояниях с повышенной фибринолитической активностью крови и тканей.
| | 5) Ксантиноксидазы
| | Аллопуринол
| Блокирует образование мочевой кислоты, препятствует накоплению уратов. Применяют для лечения подагры, при гиперурикемии, почечнокаменной болезни (с образованием уратов)
|
|

 2015-08-13
2015-08-13 2092
2092







