Йод имеет несколько степеней окисления и в растворе может существовать в виде нескольких частиц: I-, I2, IO32-.
Йод кристаллический плохо растворим в воде и хорошо растворим
в спирте. Для увеличения его растворимости в воде растворение ведут в йодиде калия, где он образует комплексное соединение – трийодид-ион I- ×I2 = I3- , проявляющее окислительные свойства [[i]]:
I3 - + 2e «3I - .
Эту реакцию чаще всего пишут в упрошенном виде, а именно:
I2 +2e «2I -; 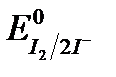 = +0,54 В.
= +0,54 В.
Раствор йода обычно готовят приблизительной концентрации
(0,05–0,1 моль/дм3), а затем перед использованием его концентрацию устанавливают по подходящему стандартному раствору (тиосульфат натрия, оксид мышьяка (III)). Растворы йода неустойчивы, так как йод – это летучее вещество, а также действует на резиновые и корковые пробки. Йодид–ионы легко окисляются кислородом воздуха:
4I- + O2 + 4H+ «2I2 + 2H2O.
Эта реакция ускоряется на свету, при нагревании и в присутствии кислот, поэтому раствор йода хранят «на холоду» и в темных бутылях с притертой стеклянной пробкой.
Определение восстановителей (SO32-, S2O32-, S2-, SCN-, AsO33-, Cr2+, HCHO, N2H2) проводят методом прямого титрования раствором I2 (йодиметрия).
Na2SO3 + I2 + 2 NaOH = Na2SO4 + 2NaI + H2O
H2S + I2 = S + 2HI
Для случаев, когда вещество реагирует с раствором йода медленно, используют метод обратного титрования (по остатку): вводят фиксированный избыток йода в раствор, оставляют его на 5–7 минут (закрытый часовым стеклом), а затем остаток йода оттитровывают раствором тиосульфата натрия.
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Для определения окислителей (Cu2+, Fe3+, Mn3+, Mn (IV), Pb (IV), As (V)) применяют титрование по замещению (йодометрия): к анализируемому раствору приливают раствор KI и выделившийся I2 титруют раствором тиосульфата натрия. Количество образовавшегося йода химически эквивалентно количеству окислителя:
2Cu2+ + 4I- = 2CuI¯ + I2
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Раствор тиосульфата натрия в иодометрическом методе является титрантом. Он проявляет свойства восстановителя:
2S2O32- - 2e «S4O62-, 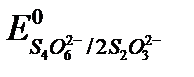 = +0,09 В.
= +0,09 В.
Тиосульфат натрия не является первичным стандартом в силу того,
что его растворы неустойчивы при хранении, мутнеют за счет поглощения CO2 из воздуха (выделяется элементарная сера):
S2O32- + H2O+CO2 «HCO3- + HS2O3–® HCO3– + HSO3– + S¯
В присутствии сильных кислот, на свету и при уменьшении концентрации тиосульфата натрия разложение ускоряется:
S2O32- + H+ «HS2O3– ® HSO3– + S¯
В присутствии серобактерий тиосульфат натрия разлагается на сульфит, сульфат и элементарную серу, поэтому его раствор с молярной концентрацией эквивалента ~ 0,1 хранят в темных, закрытых бутылях.
Стандартизуют раствор тиосульфата натрия с использованием первичных стандартов (KIO3, КВrO3, K2Cr2O7), выделяющих при взаимодействии с избытком йодид-ионов известное количество йода, которое титруют раствором Na2S2O3.
K2Cr2O7 + 6KI + 7H2SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Концентрацию тиосульфата рассчитываем по закону эквивалентов:
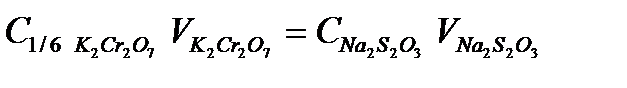 .
.
Существует несколько способов определения конечной точки при титровании йодом. При титровании бесцветных растворов достаточно интенсивной является собственная окраска трийодид-иона: 1 капля раствора йода молярной концентрации эквивалента 0,1 моль/дм3 окрашивает 100 см3 раствора в желтый цвет.
Наиболее широко используемым индикатором в йодметрии является свежеприготовленный 0,1– ный % раствор крахмала, придающий раствору, содержащему следы йода, интенсивную синюю окраску. Раствор крахмала при прямом титровании йодом добавляют в начале, а в остальных методах – в конце титрования, т.е. когда йода в растворе осталось малое количество (раствор из бурого стал бледно-желтым), так как крахмал, добавленный в раствор
с высокой концентрацией йода, разрушатся с образованием продуктов, являющихся не полностью обратимыми индикаторами. Титрование продолжают до исчезновения синей окраски крахмала.
Источники ошибок в йодометрических методах
1. Окисление йодид-иона кислородом воздуха:
4I- + O2 + 4H+ «2I2 + 2H2O
скорость этой реакции очень мала, поэтому при титровании удалять растворенный кислород из всех растворов не обязательно. Для удаления растворенного кислорода из растворов к ним добавляют бикарбонат натрия или продувают углекислый газ.
2. Летучесть выделившегося йода. Для того чтобы избежать ошибок
за счет летучести йода, растворы хранят в закрытых сосудах и избегают
их нагревания, а при косвенном титровании после добавления KI колбы
с раствором закрывают часовым стеклом и оставляют в темноте на 5–7 минут,
а затем быстро титруют.
3. Разложение растворов тиосульфата натрия.
4. Щелочные растворы. В щелочных растворах происходит образование гипоиодита:
I2 + OH- «HOI + I-
3HOI+ 3OH- «IO3- + 2I- +3H2O
В связи с этим титрование тиосульфатом натрия необходимо вести при
рН=7–10, а если необходимо титрование в кислой среде, то титрование ведут очень медленно при тщательном перемешивании.
5. Преждевременное добавление крахмала. Правильный способ применения крахмала в качестве индикатора описан выше.
 2015-08-13
2015-08-13 2918
2918








