Таблица 14. Стандартные электродные потенциалы (Е0)
В отличие от других типов реакций, для характеристики окислительно-восстановительных реакций (ОВР) чаще используют не константу равновесия, а другую фундаментальную величину – стандартный электродный потенциал Е0. Численное значение Е0 необходимо для решения многих химико-аналитических задач:
1) определение направления ОВР для выяснения возможности окисления или восстановления анализируемого вещества конкретным аналитическим реагентом с целью обнаружения или определения;
2) расчёт константы равновесия ОВР (К) для выяснения полноты протекания аналитической реакции;
3) выбор подходящего окислителя или восстановителя (на основании сравнения Е10 и Е20 или расчёта К);
4) прогнозирование возможности применения данной ОВР для проведения титриметрического определения;
5) расчёт индикаторных ошибок титрования;
6) химико-аналитические расчёты по уравнению Нернста:
- расчёт кривых окислительно-восстановительного титрования;
|
|
|
- расчёт условий проведения анализа с использованием ОВР – значения рН, концентрации реагирующих веществ, концентрации маскирующих агентов или реагентов-осадителей (учёт побочных реакций), в т. ч. с целью увеличения скачка кривой титрования.
При решении некоторых из этих задач используются следующие условия, требования и количественные критерии:
| Ø ОВР протекает в заданном направлении, если ЭДС реакции ΔЕ = Еок – Евос > 0. Если ΔЕ < 0, то ОВР протекает в обратном направлении, а если ΔЕ = 0, то наблюдается состояние равновесия. Ø Чем больше ΔЕ, тем интенсивнее, быстрее протекает ОВР. Ø Минимальное значение ΔЕ должно составлять 0,2–0,3 В. Ø Титрование с погрешностью до 0,1 % возможно при соблюдении условий: ΔЕ ³ 0,35 В, lgK ³ (n1 + n2)·3, где n1 и n2 – число электронов, участвующих в полуреакциях. |
Таблица 14
Стандартные электродные потенциалы (Е°) при 25°С
| Элемент | Полуреакция | Eo,В |
| Ag | Ag+ + e = Ag↓ | +0,7994 |
| AgBr↓ + e = Ag↓ + Br– | +0,071 | |
| AgCl↓ + e = Ag↓ + Cl– | +0,222 | |
| AgI↓ + e = Ag↓ + I– | –0,152 | |
| As | H3AsO4 + 2H+ + 2 е = HAsO2 + 2H2O | +0,56 |
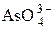 + 2H2O + 2 е = + 2H2O + 2 е = 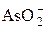 + 4ОН– + 4ОН–
| –0,71 | |
| Br | Br2 + 2 e = 2Br– | +1,087 |
2 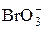 + 12H+ + 10 e = Br2↓ + 6H2O + 12H+ + 10 e = Br2↓ + 6H2O
| +1,52 | |
2 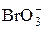 +6H2O + 10 e = Br2↓ + 12OH– +6H2O + 10 e = Br2↓ + 12OH–
| +0,50 | |
| C | CO2↑ + 2H+ + 2 e = HCOOH | –0,20 |
| 2CO2↑ + 2H+ + 2 e = H2C2O4 | –0,49 | |
| Са | Са2+ + 2 e = Ca↓ | –2,79 |
| Cd | Cd2+ + 2 e = Cd↓ | –0,403 |
| Се | Се4+ + e = Ce3+ | +1,77 |
| Сl | Сl2↑ + 2 e = 2C1– | +1,359 |
| 2HOС1 + 2Н+ + 2 e = Cl2↑+H20 | +1,63 | |
| 2C1O–+2H2O + 2 e = С12↑ +4OH– | +0,40 | |
| HC1O + H+ + 2 e = Сl– + Н2О | +1,50 |
Продолжение табл. 14
| Cl | ClO– + H2O + 2 e = Сl– + 2OН– | +0,88 |
| НСlO2+2H+ + 2 e = HClO + H2O | +1,64 | |
| 2HClO2 + 6H+ + 6 e = Cl2↑+4H2O | +1,63 | |
| HClO2 + 3H+ + 4 e = Cl– + 2H2O | + 1,56 | |
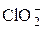 + H2O + 2 e = ClO– + 2OН– + H2O + 2 e = ClO– + 2OН–
| +0,66 | |
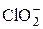 + 2H2О + 4e = C1– + 4OH– + 2H2О + 4e = C1– + 4OH–
| +0,77 | |
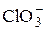 +3Н+ + 2 e = HC1O2 + H2O +3Н+ + 2 e = HC1O2 + H2O
| +1,21 | |
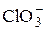 + H2O + 2e = + H2O + 2e = 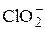 + 2OH– + 2OH–
| +0,33 | |
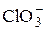 + 2H+ +e = C1O2↑ + H2O + 2H+ +e = C1O2↑ + H2O
| +1,15 | |
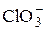 + 6H+ +6 e = Cl– + 3H2O + 6H+ +6 e = Cl– + 3H2O
| +1,45 | |
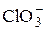 + 3H2O+6 e = Сl– + 6OН– + 3H2O+6 e = Сl– + 6OН–
| +0,63 | |
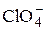 + 2H+ + 2 e = + 2H+ + 2 e = 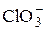 + Н2О + Н2О
| +1,19 | |
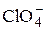 +H2O+2 e = +H2O+2 e = 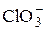 + 2OH– + 2OH–
| +0,36 | |
2 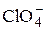 + 16H++ 14 e = С12↑ +8Н2О + 16H++ 14 e = С12↑ +8Н2О
| +1,39 | |
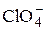 + 8H+ + 8 e = Сl– + 4Н2О + 8H+ + 8 e = Сl– + 4Н2О
| +1,38 | |
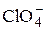 + 4H2O + 8 e = С1– + 8OН– + 4H2O + 8 e = С1– + 8OН–
| +0,56 | |
| Со | Со3+ + e = Со2+ | +1,95 |
| Со2+ + 2 e = Со↓ | –0,29 | |
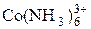 + e = + e = 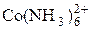
| +0,1 | |
| Cr | Cr3+ + e = Сr2+ | –0,41 |
| Сr3+ + 3 e = Сr↓ | –0,74 | |
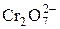 + 14Н+ + 6 e = 2Сr3+ + 7Н2О + 14Н+ + 6 e = 2Сr3+ + 7Н2О
| +1,33 | |
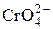 + 4Н2О + 3 e = Сr(ОН)3↓+5ОН– + 4Н2О + 3 e = Сr(ОН)3↓+5ОН–
| –0,13 | |
| Сu | Cu2+ + 2 e = Сu↓ | +0,345 |
| Cu+ + e = Сu↓ | +0,531 |
Продолжение табл. 14
|
|
|
| Сu | Cu2+ + e = Сu+ | +0,159 |
| F | F2↑ + 2 е = 2F– | +2,77 |
| Fe | Fe3+ + е = Fe2+ | +0,771 |
| Fe3+ + 3 e = Fe↓ | – 0,058 | |
| Fe2+ + 2 е = Fe↓ | – 0,473 | |
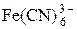 + e = + e = 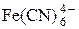
| +0,364 | |
| Ga | Ga3+ + 3 e = Ga↓ | – 0,56 |
| H | 2H+ + 2 е =H2↑ | 0,0000 |
| 2H2O + 2 е = H2↑ +2OH– | –0,828 | |
| H2O2 + 2H+ + 2 е = 2H2O | +1,77 | |
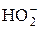 + H2O + 2 e = 3ОH– + H2O + 2 e = 3ОH–
| +0,88 | |
| Hg | 2Hg2+ + 2 е = 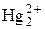
| +0,907 |
| Hg2+ + 2 е = Hg↓ | +0,850 | |
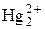 + 2 е = Hg↓ + 2 е = Hg↓
| +0,792 | |
| I | I2↓ + 2 е = 2I– | +0,536 |
| I2 + 2 е = 2I– | +0,621 | |
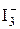 + 2 е =3I– + 2 е =3I–
| +0,545 | |
| 2IBr + 2 е = I2↓ + 2Br– | +1,02 | |
| ICN↑ + 2 е = I– + CN– | +0,30 | |
| 2ICN↑ + 2H+ + 2 е =I2↓ +2HCN | +0,63 | |
| 2ICl↑ + 2 е = I2↓ + 2Cl– | +1,19 | |
| 2НIО + 2Н+ + 2 е = I2↓+2H2O | +1,45 | |
| 2IO– + H2O + 2 е = I2↓ + 4OH– | +0,45 | |
| HIO + H+ + 2 е = I– + H2O | +0,99 | |
| IO– + H2O+2 е = I– + 2OH– | +0,49 |
Продолжение табл. 14
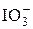 + 5H++ 4 е = HIO + 2H2O + 5H++ 4 е = HIO + 2H2O
| +1,14 | |
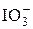 +2H2O + 4 е = IO– + 4OH– +2H2O + 4 е = IO– + 4OH–
| +0,14 | |
2 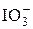 + 12H+ + 10 e = I2↓ + 6H2O + 12H+ + 10 e = I2↓ + 6H2O
| +1,19 | |
2 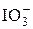 +6H2O + 10 e = I2↓ + 12OH– +6H2O + 10 e = I2↓ + 12OH–
| +0,21 | |
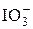 + 6H+ + 6 е = I– + 3H2O + 6H+ + 6 е = I– + 3H2O
| +1,08 | |
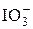 + 3H2O + 6 е = I– + 6OH– + 3H2O + 6 е = I– + 6OH–
| +0,26 | |
H5IO6 + H+ + 2 е = 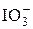 + 3H2O + 3H2O
| ≈+1,6 | |
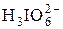 + 2 е = + 2 е = 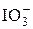 + 3OН– + 3OН–
| ≈+0,7 | |
| H5IO6 + 7H+ + 8 е = I– + 6Н2О | ≈+1,24 | |
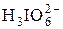 + 3H2O + 8е = I– + 9OН– + 3H2O + 8е = I– + 9OН–
| ≈+0,37 | |
| In | In3+ + 3 е =In↓ | –0,34 |
| Ir | Ir3+ + 3 е = Ir↓ | ≈+1,15 |
| К | K++ e = К↓ | –2,923 |
| La | La3+ + 3 е = La↓ | –2,52 |
| Li | Li+ + е = Li↓ | –3,04 |
| Mg | Mg2+ + 2 е = Mg↓ | –2,37 |
| Мn | Мn3+ + е = Мn2+ | +1,51 |
| Мn2+ + 2е = Мn↓ | –1,17 | |
| Mn(OH)3↓ + e = Мn(ОН)2↓ + OH– | +0,1 | |
| MnO2↓ + 4H+ + 2 е = Мn2++2Н2О | +1,23 | |
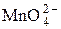 + 2H2O + 2 е =MnO2↓ + 4OH– + 2H2O + 2 е =MnO2↓ + 4OH–
| +0,58 | |
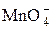 +е = +е = 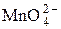
| +0,558 | |
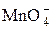 + 4H++3 е = MnO2↓ + 2H2O + 4H++3 е = MnO2↓ + 2H2O
| +1,69 | |
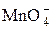 + 2H2O + 3 e = MnO2↓ + 4OH– + 2H2O + 3 e = MnO2↓ + 4OH–
| +0,60 | |
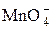 + 8H+ + 5 е = Mn2+ + 4H2O + 8H+ + 5 е = Mn2+ + 4H2O
| +1,51 |
Продолжение табл. 14
| Мо | Мо3+ + 3 е = Mo↓ | –0,2 |
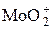 + 4H++2 e = Mo3+ + 2H2O + 4H++2 e = Mo3+ + 2H2O
| 0,0 | |
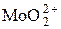 +e = +e = 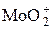
| +0,48 | |
| H2MoO4 + 6H+ + 6е = Mo↓ + 4H2O | 0,0 | |
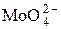 + 4Н2О + 6 е = Mo↓ + 8OH– + 4Н2О + 6 е = Mo↓ + 8OH–
| –1,05 | |
| N | HN3 + 11H+ + 8 e = 3 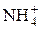
| +0,69 |
| 3N2↑ + 2H+ + 2 е = 2HN3 | –3,1 | |
3N2↑ + 2 е = 2 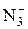
| –3,4 | |
| N2↑ + 2H2O + 4H+ + 2 е = 2(NH2OH·H+) | –1,87 | |
| N2↑ + 4H2O + 2 е = 2NH2OH+ 2OH– | –3,04 | |
| N2↑ + 5H+ + 4 е = N2H4·H+ | –0,23 | |
| N2↑ + 4H2O + 4 е = N2H4 + 4OH– | –1,16 | |
N2↑ + 8H+ + 6 е = 2 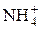
| +0,26 | |
| N2↑ + 8H2O + 6 е = 2NH4OH+ 6OH– | –0,74 | |
N2H4·H+ + 3H+ + 2 е = 2 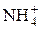
| +1,27 | |
| N2H4 + 4H2O + 2 е = 2NH4OH+ 2OH– | +0,1 | |
NH2OH·H++2H+ + 2 е = 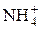 + H2O + H2O
| +1,35 | |
| NH2OH + 2H2O + 2 е = NH4OH + 2OH– | +0,42 | |
| H2N2O2 + 2H+ + 2 е = N2↑ +2H2O | +2,65 | |
| H2N2O2 + 6H+ + 4 е = 2(NH2OH·H+) | +0,50 | |
| 2HNO2+ 4H+ + 4 e = H2N2O2 + 2H2O | +0,83 | |
| HNO2 + H+ +е = NO↑ + H2O | +0,98 | |
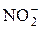 + H2O + е = NO↑+ 2OH– + H2O + е = NO↑+ 2OH–
| –0,46 | |
| 2HNO2 + 4H+ + 4 e = N2O↑ + 3H2O | +1,29 | |
| 2HNO2 + 6H+ + 4 e =N2↑ + 4H2O | +1,44 |
Продолжение табл. 14
| N | 2 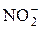 + 4H2O + 6 е = N2↑ + 8OH– + 4H2O + 6 е = N2↑ + 8OH–
| +0,41 |
HNO2 + 7H+ + 6 е = 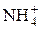 + 2H2O + 2H2O
| +0,86 | |
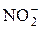 + 6H2O + 6 е = NH4OH + 7OH– + 6H2O + 6 е = NH4OH + 7OH–
| –0,15 | |
| N2O↑ + 2H+ + 2 е = N2↑ + H2O | +1,77 | |
| N2O↑ + H2O + 2 е = N2↑ + +2OH– | +0,94 | |
| 2NO↑ +4H+ + 4 e = N2↑ + 2H2O | +1,68 | |
| 2NO↑ +2H2O + 4 e = N2↑ + 4OH– | +0,85 | |
| N2O4↑ + 2H+ + 2 е = 2HNO2 | +1,07 | |
N2O4↑ + 2 е = 2 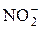
| +0,88 | |
| N2O4↑ + 8H++8е = N2↑ + 4H2O | +1,35 | |
| N2O4↑ + 4H2O + 8 е = N2↑+8OH– | +0,53 | |
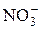 + 3H+ + 2 е = HNO2 + H2O + 3H+ + 2 е = HNO2 + H2O
| +0,94 | |
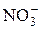 + H2O + 2 е = + H2O + 2 е = 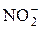 + 2OH– + 2OH–
| +0,01 | |
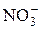 + 2H+ + е = NO2↑ + H2O + 2H+ + е = NO2↑ + H2O
| +0,80 | |
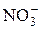 + H2O + e = NO2↑ +2OH– + H2O + e = NO2↑ +2OH–
| –0,86 | |
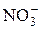 + 4H+ + 3 е = NO↑ + 2H2O + 4H+ + 3 е = NO↑ + 2H2O
| +0,96 | |
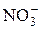 + 2H2O + 3 е = NO↑ + 4OH– + 2H2O + 3 е = NO↑ + 4OH–
| –0,14 | |
2 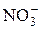 + 12H+ + 10 e = N2↑+6H2O + 12H+ + 10 e = N2↑+6H2O
| +1,24 | |
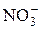 + 8H+ + 6 е = NH2OH·H+ + 2H2O + 8H+ + 6 е = NH2OH·H+ + 2H2O
| +0,73 | |
2 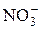 + 17H++ 14 е = N2H4·H+ + 6H2O + 17H++ 14 е = N2H4·H+ + 6H2O
| +0,84 | |
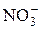 + 10H+ + 8 е = + 10H+ + 8 е = 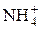 + 3H2O + 3H2O
| +0,87 | |
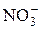 + 7H2O + 8 е = NH4OH +9OH– + 7H2O + 8 е = NH4OH +9OH–
| –0,12 | |
| Na | Na+ + e = Na↓ | –2,713 |
| Nb | Nb3+ + 3 е = Nb↓ | –1,1 |
| Ni | Ni2+ + 2 е = Ni↓ | –0,228 |
Продолжение табл. 14
| O | O2↑ + 4H+ + 4 e = 2H2O | + 1,229 |
| O2↑ + 2H2O + 4 e = 4OH– | +0,401 | |
| O2↑ + 2H+ + 2 е = H2O2 | +0,682 | |
O2↑ + H2O + 2е = 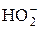 + OH– + OH–
| –0,076 | |
| H2O2 + 2H+ + 2 е = 2H2O | +1,77 | |
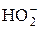 + H2O + 2 е = 3OH– + H2O + 2 е = 3OH–
| +0,88 | |
| O3↑ + 2H+ + 2 е = O2↑ + H2O | +2,07 | |
| O3↑ + H2O + 2 е = O2↑ + 2OH– | +0,02 | |
| Os | Os2+ + 2 е = Os↓ | +0,85 |
| OsO4↓ + 8H+ + 8 е = Os↓ + 4H2O | +0,85 | |
| P | P↓ + 3H+ + 3 e = PH3↑ | +0,06 |
| P↓ + 3H2O + 3 e = PH3↑+3OH– | –0,89 | |
| H3PO2 + H + + е = P↓ +2H2O | –0,51 | |
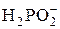 + е = P↓ + 2OH– + е = P↓ + 2OH–
| –2,05 | |
| H3PO3 + 3H+ + 3 е = P↓ + 3H2O | –0,50 | |
| H3PO3+ 2H+ + 2 е = H3PO2 + H2O | –0,50 | |
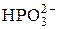 + 2Н2O + 2 е = + 2Н2O + 2 е = 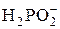 + 3OH– + 3OH–
| –1,57 | |
| H4P2O6 + 2H+ + 2 е = 2H3PO3 | +0,38 | |
| H3PO4 + 5H+ + 5 е = P↓+4H2O | –0,41 | |
| H3PO4 + 4H+ + 4 е = H3PO2 + 2H2O | –0,39 | |
| 2H3PO4 + 2H+ + 2 е = H4P2O6 + 2H2O | –0,94 | |
| H3PO4 + 2H+ + 2 е = H3PO3 + H2O | –0,276 | |
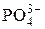 + 2H2O + 2 е = + 2H2O + 2 е = 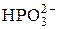 + 3ОН– + 3ОН–
| –1,12 | |
| Рb | Рb2+ + 2 е = Pb↓ | –0,126 |
| Pb4+ + 2 е = Рb2+ | +1,66 |
Продолжение табл. 14
|
|
|
| Pb | Pb4+ + 4 е = Pb↓ | +0,77 |
| PbO2↓ + H2O + 2 е = PbO↓ + 2OН– | +0,28 | |
| PbO2↓ + 4H+ + 2 е = Рb2+ + 2H2O | +1,455 | |
| Pd | Pd2+ + 2 е = Pd↓ | +0,915 |
| Pt | Pt2+ + 2е = Pt↓ | +1,2 |
| S | S↓ + 2 е = S2– | –0,476 |
| S↓ + 2H+ + 2 е = H2S↑ | +0,171 | |
| (SCN)2↑ + 2 е = 2SCN– | +0,77 | |
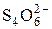 + 2 е = 2 + 2 е = 2 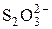
| +0,09 | |
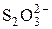 + 6H+ + 4 e = 2S↓+3Н2О + 6H+ + 4 e = 2S↓+3Н2О
| +0,5 | |
2Н2SО3 + 2Н+ + 4 e = 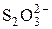 + 3H2O + 3H2O
| +0,40 | |
2 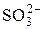 + 3H2O + 4 e = + 3H2O + 4 e = 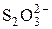 + 6OH– + 6OH–
| –0,58 | |
2H2SO3+H+ + 2 е = 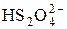 + 2Н2О + 2Н2О
| –0,08 | |
2 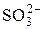 + 2H2O + 2 е = + 2H2O + 2 е = 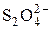 + 4OH– + 4OH–
| –1,12 | |
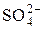 + 4H+ + 2 е = H2SO3 + H2O + 4H+ + 2 е = H2SO3 + H2O
| +0,17 | |
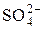 +H2O + 2 е = +H2O + 2 е = 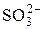 + 2OH– + 2OH–
| –0,93 | |
2 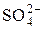 + 10H+ + 8 e = + 10H+ + 8 e = 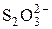 + 5Н2О + 5Н2О
| +0,29 | |
2 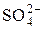 + 5H2O + 8 е = + 5H2O + 8 е = 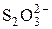 + 10OH– + 10OH–
| –0,76 | |
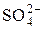 + 8H+ + 6 е = S↓ + 4H2O + 8H+ + 6 е = S↓ + 4H2O
| +0,36 | |
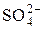 + 4H2O + 6 е = S↓ + 8OH– + 4H2O + 6 е = S↓ + 8OH–
| –0,75 | |
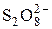 + 2 e = 2 + 2 e = 2 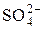
| +2,01 | |
| Sb | SbО+ + 2Н+ + 3 е = Sb↓+H2O | +0,212 |
| Sc | Sc3+ + 3 е = Sc↓ | –2,08 |
| Se | 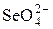 + H2O + 2 е = + H2O + 2 е = 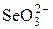 + 2OH– + 2OH–
| +0,05 |
| Si | 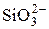 + 3H2O + 4 е = Si↓ + 6OH– + 3H2O + 4 е = Si↓ + 6OH–
| –1,7 |
Продолжение табл. 14
| Sn | Sn2+ + 2 е = Sn↓ | –0,140 |
| Sn4+ + 2 е = Sn2+ | +0,15 | |
| Sn4+ + 4е =Sn↓ | +0,01 | |
| Sr | Sr2+ + 2 е = Sr↓ | –2,89 |
| Te | 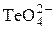 + H2O + 2 e = + H2O + 2 e = 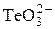 + 2OH– + 2OH–
| +0,4 |
| Th | Th4+ + 4 е = Th↓ | –1,90 |
| Ti | Ti2+ + 2е = Тi↓ | –1,63 |
| TiO2↓ + 4H+ + 4 е = Ti↓ + 2H2O | –0,86 | |
| TiO2+ + 2H+ + 4 e = Ti↓ + H2O | –0,88 | |
| TiO2+ + 2H+ + е = Ti3+ + H2O | +0,1 | |
| Ti3+ + е = Ti2+ | –0,37 | |
| Tl | Tl+ + е= Tl↓ | –0,357 |
| Тl3+ + 2 е = Tl+ | +1,25 | |
| U | U3+ + 3 е = U↓ | –1,80 |
| U4+ + е = U3+ | –0,61 | |
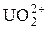 + 4H+ + 2 е =U4+ + 2H2O + 4H+ + 2 е =U4+ + 2H2O
| +0,33 | |
| V | V2+ + 2 е = V↓ | –1,18 |
| V3+ + е = V2+ | –0,255 | |
| VO2+ + 2H++ e =V3+ + H2O | +0,337 | |
| VO2+ + e = VO+ | –0,044 | |
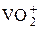 + 2H+ + е = VO2+ + H2O + 2H+ + е = VO2+ + H2O
| +1,000 | |
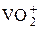 + 4H+ + 2 е = V3++ 2H2O + 4H+ + 2 е = V3++ 2H2O
| +0,668 | |
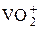 +4H+ + 3 е = V2++2H2O +4H+ + 3 е = V2++2H2O
| +0,360 | |
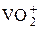 + 4H+ + 5 е = V↓ + 2H2O + 4H+ + 5 е = V↓ + 2H2O
| –0,25 | |
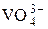 + 6H+ + 2 е =VO+ + 3H2O + 6H+ + 2 е =VO+ + 3H2O
| +1,26 |
Окончание табл. 14
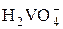 + 4H+ +е = VO2+ + 3H2O + 4H+ +е = VO2+ + 3H2O
| +1,31 | |
| W | 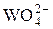 + 8H+ + 6 е = W↓ + 4H2O + 8H+ + 6 е = W↓ + 4H2O
| +0,05 |
| Y | Y3+ + 3 е = Y↓ | –2,37 |
| Zn | Zn2+ + 2 е = Zn↓ | –0,764 |
| Zn(OH)2 + 2e = Zn↓ + 2OH– | –1,245 | |
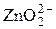 + 2H2O = Zn + 4OH– + 2H2O = Zn + 4OH–
| –1,216 | |
| Zr | ZrO2↓ + 4H+ + 4 e = Zr↓ + 2H2O | –1,43 |
 2015-09-06
2015-09-06 928
928








