Особливість задач даного типу полягає в тому, що в умові зазначається маса чи об’єм обох реагуючих речовин, одна з яких дається з кількості, більшій, ніж це необхідно для реакції (т.т. в надлишку). Під час проведення реакції частина такої речовини залишається в реакційній суміші після реакції, тому що не прореагує повністю. Для обчислення продукту реакції необхідно знати масу чи об’єм речовини, що прореагує повністю. Саме за даними цієї речовини (вважається, що вона знаходиться в недостачі) і будуть проводитися обчислення, необхідні для продукту реакції.
Алгоритм І:
1. Записати повну і скорочену умову задачі.
2. Обчислити кількості реагуючих речовин.
3. Записати рівняння реакції.
4. Обчислити за рівнянням реакції кількість іншої реагуючої речовини, потрібної для того, щоб повністю прореагував перший реагент.
5. Довести, яка з реагуючих речовин у надлишку.
6. Обчислити за рівнянням реакції кількість продукту реакції.
7. Обчислити масу (об’єм) продукту реакції.
8. Записати відповідь.
|
|
|
Алгоритм ІІ:
1. Записати повну і скорочену умову задачі.
2. Записати рівняння реакції.
3. Обчислити коефіцієнти пропорційності реагуючих речовин.
4. Довести, яка з речовин у надлишку, для чого порівняти коефіцієнти пропорційності.
5. Обчислити масу (об’єм) продукту реакції за речовиною, коефіцієнт пропорційності якої менший.
6. Записати відповідь.
Опорні формули:
ν (X) = 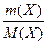 ; ν (X) =
; ν (X) = 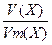 ; k =
; k = 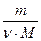 ;
;
M(прод.)= k∙М(пр.)∙υ (пр..); V(прод.)= k∙Vm∙υ (пр.)
Задача 1. Який об’єм водню виділиться при взаємодії алюмінію масою 2,16 г з розчином, що містить 9,6 г хлоридної кислоти?
| Дано: | Розв’язання: |
| m (Al) = 2,16 г m (HCl) = 9,6 г | І спосіб
1. υ (Al) = 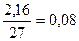 (моль); υ (HCl) = (моль); υ (HCl) = 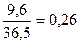 (моль)
2. 2Al + 6HCl → 2AlCl3 + 3Н2↑
3. Яка кількість речовини хлоридної кислоти потрібна для того, щоб повністю прореагував весь алюміній кількістю речовини 0,08 моль?
2: 6 = 0,08: х; х = 0,24 (моль)
4. У нас за умовою кислоти 0,26 моль, а потрібно 0,24 моль. Отже в надлишку саме HCl. Тоді алюміній у недостачі.
Подальші розрахунки проводимо за тією речовиною, яка в недостачі, тобто – за алюмінієм.
5. Яка кількість речовини водню утвориться?
2: 3 = 0,08: у; у = 0,12 (моль)
6. Який об’єм утвореного водню?
V(H2) = 0,12 ∙ 22,4 = 2,688 (л).
ІІ спосіб
2. 2Al + 6HCl → 2AlCl3 + 3Н2↑
3. Обчислюємо коефіцієнти пропорційності:
k (Al) = (моль)
2. 2Al + 6HCl → 2AlCl3 + 3Н2↑
3. Яка кількість речовини хлоридної кислоти потрібна для того, щоб повністю прореагував весь алюміній кількістю речовини 0,08 моль?
2: 6 = 0,08: х; х = 0,24 (моль)
4. У нас за умовою кислоти 0,26 моль, а потрібно 0,24 моль. Отже в надлишку саме HCl. Тоді алюміній у недостачі.
Подальші розрахунки проводимо за тією речовиною, яка в недостачі, тобто – за алюмінієм.
5. Яка кількість речовини водню утвориться?
2: 3 = 0,08: у; у = 0,12 (моль)
6. Який об’єм утвореного водню?
V(H2) = 0,12 ∙ 22,4 = 2,688 (л).
ІІ спосіб
2. 2Al + 6HCl → 2AlCl3 + 3Н2↑
3. Обчислюємо коефіцієнти пропорційності:
k (Al) = 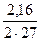 =0,04; k (HCl) = =0,04; k (HCl) = 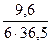 =0,044
4. Коефіцієнт пропорційності менший у алюмінію, отже знаходимо об’єм водню саме за ним:
V(H2) = 0,04 ∙22,4∙3=2,688 (л) =0,044
4. Коефіцієнт пропорційності менший у алюмінію, отже знаходимо об’єм водню саме за ним:
V(H2) = 0,04 ∙22,4∙3=2,688 (л)
|
| V(H2) -? | |
| Відповідь: об’єм утвореного водню становить 2,688 л |
 2015-09-06
2015-09-06 612
612








