Запишем уравнение реакции между фотоном и нейтральным атомом натрия.
Полная запись с участием фотонов приобретает вид:
Na0 + hv1 = Na+ + e-. (4.4)
Сделанная запись показывает, что атом натрия (свободный) не может сам отдать электрон и превратиться в ион натрия, так как отрыв электрона требует выполнения "работы выхода", которая и совершается под действием фотона с частотой v1. Нижний индекс - 1 - характеризует частоту, которая необходима для отрыва электрона.
Эта частота - является важнейшей КОНСТАНТОЙ для всей фотохимии, так как ее физический смысл, имеющий теоретическое обоснование только для спектра водорода, носит название константы Ридберга. Теоретического подхода к вычислению аналогичной величины для самых разнообразных атомов и молекул НЕ СУЩЕСТВУЕТ. Сами же эти величины легко определяются экспериментально, а наличие таблиц этих величин КВАНТОВОЙ ХИМИИ позволит надеяться на создание адекватной теории.
Желая указать связь этой константы с константой Ридберга, мы будем называть ее "Ридс", где буква "с", написанная через черточку, означает "специфичность" этой константы, определяемой из условий реакции.
|
|
|
13. Константы фотохимического равновесия
Запишем константу фотохимического равновесия для первой стадии химического процесса:
Kфотохим1 = 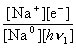 = Kфх1. (4.5)
= Kфх1. (4.5)
Запись справа является сокращением записи константы слева, так как левая требует слишком много букв. Но это не значит, что у новых констант фотохимического равновесия не было отличия от традиционной записи.
Запишем уравнение реакции между свободным электроном и нейтральным атомом хлора. Полная запись с участием фотонов приобретает вид:
Cl0 + e- = Cl- + hv2. (4.6)
Здесь захват электрона нейтральным атомом хлора связан с выделением "энергии сродства к электрону", которая высвечивается в виде фотона с частотой v2.
Запишем константу фотохимического равновесия для этой стадии химического процесса:
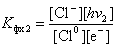 .
.
Последняя стадия этого химического процесса состоит в образовании связи между ионами натрия и хлора, а энергия образовавшейся связи выделяется в виде фотона с частотой v3:
Na+ + Cl- = NaCl + hv3. (4.7)
Запишем константу фотохимического равновесия и для этой стадии химического процесса:
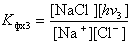 . (4.8)
. (4.8)
Последняя константа фотохимического равновесия отличается от обычной константы, принятой в химии тем, что в знаменателе стоят ионы, а не свободные атомы натрия и хлора. Но, пользуясь выражениями (4.4) и (4.6), можно совершить замену. Используя формулу (4.5) находим выражение для иона натрия, фигурирующего в формуле (4.8):
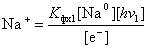 . (4.9)
. (4.9)
Подобным образом находим:
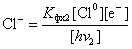 . (4.10)
. (4.10)
Нетрудно видеть, что сокращая концентрацию электронов, получим:
|
|
|
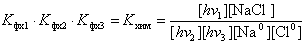 . (4.11)
. (4.11)
Полученный результат показывает, что полное выражение урезанной константы химического равновесия, игнорирует излучение, которое используется в химическом процессе.
Но до сих пор эта урезанная запись не приводила к особым недоразумениям. Это так и будет, если излучение соответствует формуле Планка, дающей распределение излучения в спектре абсолютно черного тела.
Если же, под действием внешних источников, плотность излучения отличается от того, что следует из формулы Планка, то мы и обнаруживаем несостоятельность обычной константы. Эта возможность и используется при подаче резонансного излучения в сферу реакции.
14. Тепловой эффект химической реакции
Мы еще не выразили тепловой эффект химической реакции Q через участников реакции при полном описании. Нетрудно видеть, что тепловой эффект химической реакции легко выражается через фотоны. Алгебраическая сумма поглощенных и излученных фотонов дает выражение для теплового эффекта реакции.
 2015-10-16
2015-10-16 427
427








