Следует отметить, что простейший способ получения 1,2 -, 1,4 - и 1,6 - модели гетероатомом замены, чтобы начать с ними. Биохимические и промышленные процессы могут обеспечить недорогим источником химических веществ, которые обычно недоступны модели замещения. Например, аминокислоты, щавелевая кислота, янтарная кислота, адипиновой кислоты, винной кислоты, глюкозы и имеются в изобилии и обеспечивают модели нестандартных замещения.
Методы построения карбоциклов. Применение карбенов и карбеноподобных частиц для построения трехчленного цикла (реакция Симмонса-Смита и т.д.). Аннелирование по Робинсону. Реакция Дильса-Альдера (общие представления о механизме и селективности процесса). Понятие о других перициклических реакциях.
СИММОНСА - СМИТА РЕАКЦИЯ, превращение алкенов в циклопропаны под действием метилиодида и пары Zn-Cu.
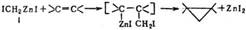
Пару Zn-Cu обычно получают нагреванием Zn-пыли с CuCl в эфире в атмосфере N2. В эфире осуществляют и основную р-цию.
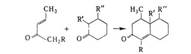
АННЕЛИРОВАНИЕ (от лат. annellus, anellus - колечко) (аннулизация), пристраивание карбо- или гетероцикла к существующей циклич. системе. наиб. распространено аннелирование по Робинсону, напр. :
Реакция Ди́льса — А́льдера (диеновый синтез, циклоприсоединение) — реакция (4+2) циклоприсоединение диенофилов (веществ, содержащих кратную связь, активированную соседней электроноакцепторной группой) к сопряженным диенам с образованием шестичленного цикла.
В реакцию вступают циклические и ациклические 1,3-диены, енины (алкинилалкены -C=C-CΞC-) или их гетероаналоги — соединения с фрагментами -С=С-С=О, -С=С-СN,.
Диенофилами обычно являются алкены и алкины с активированной электронакцепторными заместителями кратной связью. В роли диенофилов также могут выступать соединения, содержащие двойные связи с гетероатомом, например >С=О, >С=N-, -СN, -N=О, -S=O, -N=N-

Образование 2 новых связей происходит синхронно.
ДИЕНОВЫЙ СИНТЕЗ (реакция Дильса - Альдера) - конденсация сопряженных диенов с диенофилами (соединениями, содержащими, напр., связь С=С, активированную группами =СО, -СООН, -СN и др.). Продукты диенового синтеза- циклические соединения; напр., из бутадиена (I) и малеинового ангидрида (II) образуется тетрагидрофталевый ангидрид (III): Используется для синтеза полициклических соединений.
ПЕРИЦИКЛИЧЕСКИЕ РЕАКЦИИ (от греч. peri-вокруг и kyklos - круг), процессы, при к-рых реорганизация связей происходит по периметру многоугольника, образованного атомами, участвующими в формировании переходного состояния:
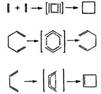
Обязат. условие отнесения р-ции к типу перициклических реакций -ее согласованность (одностадийность, синхронность, концертность). В перициклических реакциях в формировании переходного состояния принимают участие по одной орбитали от каждого входящего в него атома. К перициклическим реакциям относятся электроциклические реакции, сигма-тропные перегруппировки, циклоприсоединение (циклораспад).
Методы генерирования двойных связей. Дегидрирование. Последовательность галогенирование–дегидрогалогенирование, закономерности регио- и стереоселективности реакций. Реагенты для элиминирования галогеноводорода из галогенпроизводных. Реакции элиминирования с участием спиртов и сложных эфиров (ксантогенатов, ацетатов). Элиминирование по Гофману и его региохимические особенности. Генерирование двойных связей из алкинов.
Методы получения алкенов:
1. Дегидрирование алканов
Это один из промышленных способов получения алкенов. Температура: 350—450 °C, катализатор — Cr2O3. Также используются алюмомолибденовые и алюмоплатиновые катализаторы.
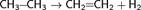
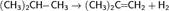
2. Дегидрогалогенирование и дегалогенирование алканов
Отщепление галогенов у дигалогеналканов происходит в присутствии цинка:
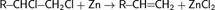
Дегидрогалогенирование проводят при нагревании действием спиртовыми растворами щелочей
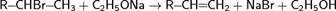
При отщеплении галогенводорода образуется смесь изомеров, преобладающий из которых определяется правилом Зайцева: отщепление протона происходит от менее гидрогенизированного атома углерода.
3. Дегидратация спиртов
Дегидратацию спиртов ведут при повышенной температуре в присутствии сильных минеральных кислот
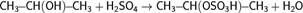
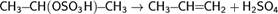
4. Гидрирование алкинов
Частичное гидрирование алкинов требует специальных условий и наличие катализатора (например, дезактивированного палладия — катализатора Линдлара)
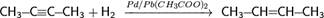
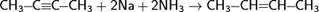
5. Галогенирование алкинов
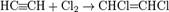
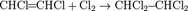
Элиминирование ( от лат. elimino — изгоняю) — это отщепление двух атомов или групп атомов от соседних атомов углерода с образованием между ними π-связи. Атомы углерода при элиминировании переходят из sр3- в sp2-гибридное состояние (или из sр2- в sp). Исходными веществами могут служить представители разных классов органических соединений.
Методы получения насыщенных (алкильных) фрагментов: восстановление кратных связей углерод-углерод и углерод–кислород (по Клемменсену, Кижнеру-Вольфу), восстановление других функционально замещенных соединений. Синтез алканов из солей карбоновых кислот электрохимическим путем и по Хунсдиккеру-Бородину.
 2015-10-16
2015-10-16 1076
1076








