Поверхностные явления принято классифицировать в соответствии с объединенным уравнением первого и второго начал термодинамики, в которое входят основные виды энергии. Для любой гетерогенной системы его можно записать в следующем виде:

Это уравнение показывает приращение энергии Гиббса через алгебраическую сумму приращений других видов энергии. Очевидно, что поверхностная энергия способна переходить в следующие виды энергии:
Энергия Гиббса
Теплота
Химическая энергия
Механическая энергия
Электрическая энергия
Превращение поверхностной энергии в один из перечисленных видов энергии соответствует определенным поверхностным явления, таким как изменение реакционной способности при изменении дисперсности, адгезия и смачивание, капиллярность, адсорбция, электрические явления.
Билет
1. Эксикаторы — приборы, применяемые для медленного высушивания и для сохранения веществ, легко поглощающих влагу из воздуха. Эксикаторы закрывают стеклянными крышками, края которых притерты к верхней части цилиндра. Различают два основных типа эксикаторов: обыкновенные (рис.63) и вакуум-экс и* каторы (рис. 64). Последние имеют отверстие, в ко*, торое на резиновой пробке вставляют трубку с краном или же в крышке имеется тубус с притертой пробкой, к которой припаяна стеклянная трубка с краном; это дает возможность соединять эксикатор с вакуум-насосом и, создавая внутри эксикатора уменьшенное давление, ве-сти высушивание под вакуумом (рис. 65). Между ваку-ум-эксикатором / и вакуум-насосом обычно помещают манометр 2 и предохранительную склянку 3.
|
|
|
Некоторые вакуум-эксикаторы (см. рис. 64) имеют приспособление для обогрева при помощи электричества, В таком эксикаторе возможно вести высушивание в вакууме при подогреве. Впускать воздух в вакуум-эксикатор нужно очень осторой(но, так как струя врывающегося воздуха может разбросать высушиваемое вещество. Поэтому впускной кран нужно поворачивать очень медленно и поднимать крышку только через несколько минут пс(сле того, как впускной кран будет приоткрыт.
Внутрь эксикатора, на дно цилиндра, над конусообразной частью, обычно кладут фарфоровую вкладку,(рис. 66). Вместо вкладок можно пользоваться обычным
Вопрос 2. По способу монохроматизации потока излучений. Для получения монохроматических излучений используют светофильтры, призмы, дифракционные решетки.
Селективные фильтры используют либо для выделения узкой спектральной области (узкополосные), либо для отделения широкой области спектра. Лучшие узкополосные фильтры имеют полосу пропускания 0,1 нм, однако количество пропускаемого ими излучения невелико, поэтому основное назначение светофильтров при спектральных исследованиях — грубая монохроматизация или неселективное ослабление излучения. Наибольшее применение в практике спектрального анализа получили абсорбционные фильтры, принцип действия которых основан на избирательном поглощении излучения веществом фильтра.
|
|
|
Вопрос 3.
Термодинами́ческие потенциа́лы — внутренняя энергия  , рассматриваемая как функция энтропии
, рассматриваемая как функция энтропии  и обобщённых координат
и обобщённых координат  [1] (объёма системы, площади поверхности раздела фаз, длины упругого стержня или пружины, поляризации диэлектрика,намагниченности магнетика, масс компонентов системы и др.[2]), и термодинамические характеристические функции, получаемые посредством применения преобразования Лежандра[3][4] к внутренней энергии
[1] (объёма системы, площади поверхности раздела фаз, длины упругого стержня или пружины, поляризации диэлектрика,намагниченности магнетика, масс компонентов системы и др.[2]), и термодинамические характеристические функции, получаемые посредством применения преобразования Лежандра[3][4] к внутренней энергии
 .
.
Цель введения термодинамических потенциалов — использование такого набора естественных независимых переменных, описывающих состояние термодинамической системы, который наиболее удобен в конкретной ситуации, с сохранением тех преимуществ, которые даёт применение характеристических функций с размерностью энергии. В частности, убыль термодинамических потенциалов в равновесных процессах, протекающих при постоянстве значений соответствующих естественных переменных, равна полезной внешней работе.
Термодинамические потенциалы были введены У. Гиббсом, говорившим о «фундаментальных уравнениях (fundamental equations)»[5][6]; термин термодинамический потенциал принадлежит Пьеру Дюгему[7].
Выделяют следующие термодинамические потенциалы:
внутренняя энергия
энтальпия
свободная энергия Гельмгольца
потенциал Гиббса
большой термодинамический потенциал
Вопрос 4. По степени раздробленности (дисперсности) системы делятся на следующие классы: грубодисперсные, размер частиц в которых более 10-5 м; тонкодисперсные (микрогетерогенные) с размером частиц от 10-5 до 10-7 м; коллоидно-дисперсные (ультрамикро-гетерогенные) с частицами размером от 10-7 до 10-9м. Если фиксировать внимание на двух основных компонентах дисперсных систем, то одному из них следует приписать рольдисперсионной среды, а другому - роль дисперсной фазы. В этом случае все дисперсные системы можно классифицировать по агрегатным состояниям фаз.
Эта классификация была предложена Оствальдом и широко используется до настоящего времени. Недостаткомклассификации следует считать невозможность отнесения дисперсных систем, приготовленных с твердой или жидкойдисперсной фазой, к какому-либо классу, если размер частиц составляет несколько нанометров. Пример такойклассификации приведен в табл. 1.
Академик П.А. Ребиндер предложил более совершенную классификацию дисперсных систем по агрегатным состояниям фаз. Он разделил все дисперсные системы на два класса: свободнодисперсные системы и сплошные (или связнодисперсные) системы (табл. 2 и 3). В свободнодисперсных системах дисперсная фаза не образует сплошных жестких структур (сеток, ферм или каркасов). Эти системы называют золями. В сплошных (связнодисперсных) системах частицы дисперсной фазы образуют жесткие пространственные структуры (сетки, каркасы, фермы). Такие системы оказывают сопротивление деформации сдвига. Их называют гелями.
Дисперсная система по классификации Ребиндера обозначается дробью, в которой дисперсная фаза ставится в числителе, а дисперсионная среда – в знаменателе. Например: Т1/Ж2. Индекс 1 обозначает дисперсную фазу, а индекс 2 – дисперсионную среду.
Коллоидная химия изучает свойства как тонко-, так и грубодисперсных систем; как свободно-, так и связнодисперсных систем.
Включение в одну науку столь большого количества разнообразных систем, различных как по природе фаз, так и по размерам частиц и агрегатному состоянию фаз, основано на том, что все они обладают общими свойствами - гетерогенностью и принципиальной термодинамической неустойчивостью. Центральное место в коллоидной химиизанимают ультрамикрогетерогенные системы со свободными частицами. Это - так называемые, коллоидные системы.
|
|
|
Коллоидные системы необычайно лабильны, т.е. неустойчивы. Для многих из них достаточно прибавления ничтожного количества электролита, чтобы вызвать выпадение осадка. Причина столь легкого изменения состоянияколлоидных систем связана с непостоянством степени их дисперсности. Различают два вида устойчивости любой раздробленной системы - кинетическую и агрегативную.
| 3. Дисперсные системы в твердых телах |
| Т1/Т2 – твердые золи, например, золь золота в стекле, пигментированные волокна, наполненные полимеры |
В основу этой классификации положено агрегатное состояние фаз дисперсной системы.
Понятие агрегативной устойчивости, которое впервые ввел Н.П. Песков, подразумевает отсутствие агрегирования, т.е. снижения степени дисперсности коллоидной системы при хранении. Для определения кинетической устойчивости необходимо изучать условия выделения диспергированных частиц в гравитационном или центробежном поле. Скорость подобного выделения зависит от интенсивности броуновского движения частиц, т.е. от степени дисперсности системы и разности плотности дисперсионной среды и дисперсной фазы, а также от вязкостисреды.
Билет № 36
Вопрос № 1 «Стандартные растворы, способы их приготовления. Примеры»
Стандартные растворы. Стандартными называют растворы с разными, точно определенными концентрациями, применяемые в колориметрии, например растворы, содержащие в 1 мл 0,1, 0,01, 0,001 мг и т. д. растворенного вещества.
Кроме колориметрического анализа, такие растворы бывают нужны при определении рН, при нефелометрических определениях и пр. Иногда стандартные растворы" хранят в запаянных ампулах, однако чаще приходится готовить их непосредственно перед применением. Стандартные растворы готовят в объеме не больше 1 л, а ча ще — меньше. Только при большом расходе стандартного раствори можно готовить несколько литров его и то при условии, что стандартный раствор не будет храниться длительный срок.
|
|
|
Количество вещества (в г), необходимое для получения таких растворов, вычисляют по формуле:

Вопрос № 2 «Объективные ошибки фотометрии, рассмотреть на примере зависимости А от t°, С, τ, РН – среды.»
Объективные ошибки фотометрии
Источниками ошибок при фотометрировании могут быть отклонения от закона Бугера- Ламберта - Бера и особенности возникающей окраски. Реакцию переведения определяемого иона в окрашенное соединение можно представить уравнением Х + R ХR (II-9)где X - определяемый ион в большинстве случаев бесцветный или слабоокрашенный; - реагент, окрашенный иначе, чем соединение ХR; ХВ - окрашенное соединение.
Рассмотренная реакция обратима и константа диссоциации соединения ХR выражается уравнением: [Х] [R] a2= ---- = C--- (II - 10) [ХR] 1- a
где С - концентрация окрашенного соединения ХR;
а - степень диссоциации соединения ХR.
Интенсивность окраски раствора, зависящая от соотношения концентраций окрашенных и бесцветных частиц, изменяется с изменением общей концентрации раствора, так как при этом происходит одновременное изменение степени диссоциации. В результате при разбавлении или при концентрировании растворов наблюдаются отклонения от основного закона фотометрии.
При фотометрировании необходимо соблюдать постоянную температуру; однако влияние температуры в большинстве случаев незначительно, и поэтому она должна поддерживаться постоянной в пределах 1-3 С. Различие зависимости поглощения от температуры используется в термоспектрофотометрическом методе анализа.
Вопрос № 3 «Полярные и неполярные молекулы.Факторы, определяющие полярность молекулы.»
Деление молекул на полярные и неполярные имеет важное практическое значение. Вспомните, например, правило: подобное растворяет подобное.
Полярные молекулы имеют ненулевой дипольный момент (μ  0). У неполярных молекул, соответственно, μ=0.
0). У неполярных молекул, соответственно, μ=0.
Примерами неполярных молекул являются молекулы Н2, N2, BF3, CH4, UF6, PF5 и т.д.
К полярным молекулам относятся HCl, NH3, H2O, CH3Cl, H2C==CHCl, Li2O и т.д.
Дипольный момент молекулы может быть равен нулю по двум причинам:
1. Из-за случайной компенсации неравномерностей распределения электрических зарядов. Этот случай встречается редко.
2. Из-за симметрии ядерной конфигурации молекулы. Эта причина встречается часто и является важной.
Полярность молекул
Молекулы, которые образованы атомами одного и того же элемента, как правило, будут неполярными, как неполярны и сами связи в них. Так, молекулы Н2, F2, N2 неполярны.
Молекулы, которые образованы атомами разных элементов, могут быть полярными и неполярными. Это зависит от геометрической формы.
Если форма симметрична, то молекула неполярна (BeH2, BF3, CH4, CO2, SO3), если асимметрична (из-за наличия неподелённых пар или неспаренных электронов), то молекула полярна (NH3, H2O, SO2, NO2). При замене одного из боковых атомов в симметричной молекуле на атом другого элемента также происходит искажение геометрической формы и появление полярности, например в хлорпроизводных метана CH3Cl, CH2Cl2 и CHCl3 (молекулы метана CH4 неполярны). Полярность несимметричной по форме молекулы вытекает из полярности ковалентных связей между атомами элементов с разной электроотрицательностью. Как отмечалось выше, происходит частичный сдвиг электронной плотности вдоль оси связи к атому более электроотрицательного элемента, например:
| Hδ+ → Clδ− | Bδ+ → Fδ− |
| Cδ− ← Hδ+ | Nδ− ← Hδ+ |
(здесь δ - частичный электрический заряд на атомах).
Чем больше разность электроотрицательностей элементов, тем выше абсолютное значение заряда δ и тем более полярной будет ковалентная связь.
Вопрос № 4 «Особенности коллоидных ПАВ.Солюбилизация.» Классификация ПАВ

Пове́рхностно-акти́вные вещества́ (ПАВ) — химические соединения, которые, концентрируясь на поверхности раздела термодинамических фаз, вызывают снижение поверхностного натяжения.
Основной количественной характеристикой ПАВ является поверхностная активность — способность вещества снижать поверхностное натяжение на границе раздела фаз — это производная поверхностного натяжения по концентрации ПАВ при стремлении С к нулю. Однако, ПАВ имеет пределрастворимости (так называемую критическую концентрацию мицеллообразования, или ККМ), с достижением которого при добавлении
Солюбилизация (от позднелатинского solubilis — растворимый)
коллоидное растворение, самопроизвольное и обратимое проникание какого-либо низкомолекулярноговещества (солюбилизата), слабо растворимого в данной жидкой среде, внутрь находящихся в ней мицелл поверхностно-активного вещества или молекулярных клубков (глобул) высокомолекулярногосоединения. С. характерна для полуколлоидных систем типа водныхрастворов мыл и синтетических моющих веществ при концентрациях выше критической концентрациимицеллообразования, а также для растворов белков и некоторых синтетических полимеров.
Билет № 37
Вопрос № 1 «Иодометрия. Рабочие растворы, установочные вещества, индикаторы, условия титрования метода.»
Иодометрия — титриметрический (объёмный) метод определения веществ, основанный на реакциях окисления-восстановления (разновидность оксидиметрии) с участием иода или иодида калия:

Стандартный электродный потенциал данной реакции составляет +0,5355 В.
Прямое иодометрическое титрование непосредственно раствором I2 может быть использовано, в частности, для титрования восстановителей в присутствии избытка KI:
Этим способом определяют концентрацию As(III), Sn(II), Sb(III), сульфидов, сульфитов, тиосульфатов и др.:

Косвенное иодометрическое титрование используется для титрования окислителей; в этом случае определяемые вещества взаимодействуют с избытком KI с образованием иода, который оттитровывается раствором тиосульфата натрия. Этот способ используется для определения концентрации Cu(II), H2O2, Br2, BrO3-, ClO-


Иодометрический метод анализа используется также для определения концентрации ионов H+:

Иодометрический метод анализа является также основой метода Фишера по определению воды в органических растворителях.
Одни из самых распространенных индикаторов – кислотно-щелочные. Они применяются в тех случаях, когда в ходе титрования, т.е. постепенного добавления реагента к анализируемому раствору изменяется рН среды.
Вопрос № 2 «Сущность рефактометрического анализа»
Рефрактометрия (от лат. refractus — преломленный и др.-греч. μετρέω «измеряю») — это метод исследования веществ, основанный на определении показателя (коэффициента) преломления (рефракции) и некоторых его функций. Рефрактометрия (рефрактометрический метод) применяется для идентификации химических соединений, количественного и структурного анализа, определения физико-химических параметров веществ. Относительный показатель преломления n представляет собой отношение скоростей света в граничащих средах. Для жидкостей и твердых тел n обычно определяют относительно воздуха, а для газов — относительно вакуума (абсолютный показатель преломления). Значения n зависят от длины волны λ света и температуры, которые указывают соответственно в подстрочном и надстрочном индексах. Например, показатель преломления при 20 °C для D-линии спектра натрия (λ = 589 нм) —  . Часто используют также линии спектра водорода Н (λ = 656 нм) и F (λ = 486 нм). В случае газов необходимо также учитывать зависимость n от давления (указывать его или приводить данные к нормальному давлению).
. Часто используют также линии спектра водорода Н (λ = 656 нм) и F (λ = 486 нм). В случае газов необходимо также учитывать зависимость n от давления (указывать его или приводить данные к нормальному давлению).
n=n1V1+n2V2,
где n, n1,n2 — показатели преломления смеси и компонентов, V1 и V2 — объемные доли компонентов (V1 + V2 = 1).
Вопрос № 3 «дайте определения понятию система. Открытая, закрытая и изолированная системы».
Системой называют произвольную часть пространства, где содержится по крайней мере одно (или несколько) веществ. Внутри системы (между ее отдельными частями) может происходить химическое взаимодействие или перераспределение массы и энергии.
ОТКРЫТАЯ СИСТЕМА, термодинамич. Система, способная обмениваться с окружающей средой в-вом и энергией. Такой обмен может сопровождаться также изменением объема системы. В рамках статистич. термодинамикиоткрытая система с фиксир. Объемом принадлежит большому канонич. Ансамблю, окружающая среда для системы является резервуаром энергии и частиц компонентов, т.е. определяет т-ру и хим. Потенциалы компонентов и условияхим. И фазового равновесия, поведение р-ров и реальных газов
ЗАКРЫТАЯ СИСТЕМА, термодинамич. Система, не обменивающаяся в-вом с окружающей средой (для открытой системы такой обмен возможен). Закрытая система заключена в непроницаемую для частиц (атомов, молекул,ионов) оболочку (реальную или воображаемую), но эта оболочка м. б. проницаемой для тепла и нежесткой, т. Е. энергия закрытой системы и ее объем могут в общем случае изменяться, если эти параметры не закреплены дополнит.
Внутри закрытой химической системы число атомов остаётся неизменным, хотя они могут вступать в различные химические реакции и образовывать разные молекулы. Математически общее число атомов какого-либо химического элемента, обозначенного индексом  , в закрытой системе равно:
, в закрытой системе равно:
 ,
,
где  есть количество молекул, обозначаемых индексом
есть количество молекул, обозначаемых индексом  , изменяющимся от 1 до m для различных типов молекул,
, изменяющимся от 1 до m для различных типов молекул,  есть число атомов с индексом
есть число атомов с индексом  в молекуле с индексом
в молекуле с индексом  . Подобное соотношение можно составить для каждого вида атомов.
. Подобное соотношение можно составить для каждого вида атомов.
ИЗОЛИРОВАННАЯ СИСТЕМА (замкнутая система), термодинамич. Система, заключенная в жесткую, непроницаемую для тепла и внеш. Полей оболочку (реальную или воображаемую). Изолированная система является закрытой, так что при отсутствии хим. Превращений массы всех компонентов в ней постоянны, т е. число молейкаждого компонента ni = const, где i = 1,2, …, k (k – число компонентов системы). Кроме того, фиксированы внутр. Энергия Е системы и ее объем V Т. Обр., состояние изолированной системы задано параметрами Е, V, n1, п2, …, nkВсе остальные величины, характеризующие св-ва системы, являются ф-циями этих независимых параметров. Если в системе происходят хим. Превращения, условие ni = const заменяется требованием постоянства чисел атомов каждого вида, т.е. постоянства общей массы в-ва в системе и ее атомного состава.
Вопрос № 4 «Приведите классификации диперсных систем по дисперсности и агрегатному состоянию.»
| Дисперсион-ная среда | Дисперс-ная фаза | Примеры дисперсных систем |
| Твердая | Твердая | Рубиновое стекло; пигментированные волокна;сплавы; рисунок на ткани, нанесенный методом пигментной печати |
| Твердая | Жидкая | Жемчуг, вода в граните, вода в бетоне, остаточныймономер в полимерно-мономерных частицах |
| Твердая | Газо- образная | Газовые включения в различных твердых телах: пенобетоны, замороженные пены, пемза |
Билет № 38
Вопрос № 1 " Метод прямого перманганатометрического титрования, на примере определения железа (II) в соли Мора». При титровании двухвалетного железа перманганатом калия протекает следующая реакция:
 Fe2+ – 1е ® Fe3+ 5
Fe2+ – 1е ® Fe3+ 5
MnO4– + 8H+ + 5е ® Mn2+ + 4H2O 1

|
5Fe2+ +MnO4– + 8H+® Mn2+ + 5Fe3+ + 4H2O
M(Fe) = 55,85 г/моль;
E0(Fe3+/Fe2+) = +0,77B.
Полученный для анализа раствор разбавляют дистиллированной водой в мерной колбе на 100 мл до метки, перемешивают и отбирают на титрование в коническую колбу 1/5 часть раствора (Vпипетки = 20,00 мл), добавляют 10 мл 2н. серной кислоты и титруют раствором перманганата калия до устойчивой розовой окраски.
Вопрос № 2 «Механизм каогуляции. Концентрационная и нейтрализационная каогуляция.»
Молекулярная рефракция — мера электронной поляризованости вещества, она имеет размерность объема, по порядку величины совпадает с объемом всех молекул в граммолекуле. Из этого следует, что порядок величины R должен совпадать с поправкой на объем в уравнении Ван-дер-Ваальса, что подтверждается значениями этих величин, получеными во время опытов
связывает молекулярную поляризуемость вещества с его показателем преломления n.

d — плотность вещества, M — его молекулярная масса.
| Расчетные методы: | ||
| Метод Лоретца-Лоренца: | ||
| Мольная рефракция (формула Лорентца-Лоренца) определяется следующим образом: | ||
| ||
| Метод Эйзенлора (аддитивный метод): | ||
| Энзенлор предложил аддитивный метод для расчета мольной рефрации. Расчет ведется по формуле: | ||
| ||
| где gi - значение доли мольной рефракции для i-ой группы; ni - число групп i-го типа. | ||
| Метод Фогеля (аддитивный метод): | ||
| Данный метод полностью аналогичен предыдущему.Фогель уточнил и дополнил таблицу Энзенлора. Расчетная формула: | ||

|
Вопрос № 3 «первый закон термодинамики»
Согласно первому началу термодинамики, термодинамическая система (например, пар в тепловой машине) может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии.
Сущность первого начала термодинамики заключается в следующем:
При сообщении термодинамической системе некоторого количества теплоты Q в общем случае происходит изменение внутренней энергии системы D U и система совершает работу А:
| Q = D U + A | (1.4) |
выражающее первое начало термодинамики, является определением изменения внутренней энергии системы (D U), так как Q и А — независимо измеряемые величины.
Внутреннюю энергию системы U можно, в частности, найти, измеряя работу системы в адиабатном процессе (то есть при Q = 0): А ад = — D U, что определяет U с точностью до некоторой аддитивной постоянной U0:
| U = U + U0 | (1.5) |
Первое начало термодинамики утверждает, что U является функцией состояния системы, то есть каждое состояние термодинамической системы характеризуется определённым значением U, независимо от того, каким путём система приведена в данное состояние
Вопрос № 4 «Механизм каогуляции. Концентрационная и нейтрализационная каогуляция.»
Устойчивость дисперсных систем обусловлена их лиофильностью, т.е. способностью притягивать растворитель в сольватные (гидратные) оболочки за счет молекулярного взаимодействияЕсли частицы несут отрицательный заряд, то наиболее сильными коагулянтами являются многовалентные катионы, например: Fe3+,Al3+и др.
Положительно заряженные частицы коагулируются при давлении в раствор анионов.
Коагуляция растворов белков и др. биохимически активных веществ осуществляется за счет:
1. нагревания;
2. добавления солей тяжелых металлов;
3. нейтральных солей при высоких концентрациях (высаливание);
4. трихлоруксусной, сульфосалициловой кислотой;
5. танина и др. дубильных веществ;
6. органических растворителей (спирта, ацетона и др.).
Нейтрализационная коагуляция происходит при добавлении к золю неидифферентного электролита. При этом потенциалобразующие ионысвязываются в малорастворимое соединение, что приводит к уменьшению по абсолютной величине термодинамического, а, следовательно, и электрокинетического потенциалов (рис. 31). Когда электрокинетический потенциал достигнет 30 мВ, начнется коагуляция и разрушение дисперсной системы.
Рассмотрим в качестве примера положительный золь гидроксида железа:
 .
.
Билет №39
1) Метод прямого перманганатометрического титрования, на примере определения железа (II) в соли Мора.
ПЕРМАНГАНАТОМЕТРИЯ – метод объемного (титриметрического) химического анализа, основанный на применении стандартного (имеющего строго определенную концентрацию) раствора перманганата калия KMnO4.
Соль Мора-двойная соль (NH4)2Fe(So4)2*6H2O,наиболее устойчивое соединение,содержащее железо(II). Анализ проводят методом прямого титрования соли Мора стандартным раствором перманганата калия.При этом ионы железа F  легко окисляются перманганат ионом MnO
легко окисляются перманганат ионом MnO  в ионы железа F
в ионы железа F  в кислой среде:
в кислой среде:
2 Mn  +16
+16  +10F
+10F  → 2M
→ 2M  +8H2O +10F
+8H2O +10F 
в молекулярном виде:
2KMnO4+10(NH4)2Fe(SO4)2+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+10(NH4)2 SO4+8H2O
Так как ион  ,окисляясь в ион
,окисляясь в ион  ,повышает степень окисления на единицу(отдает 1 электрон), то молярная масса эквивалента соли Мора совпадает с его молярной массой, т.е число эквивалентности равно 1, то
,повышает степень окисления на единицу(отдает 1 электрон), то молярная масса эквивалента соли Мора совпадает с его молярной массой, т.е число эквивалентности равно 1, то  (NH4)2Fe(SO4)2*6H2O= М (NH4)2Fe(SO4)2*6H2O, и соответственно молярная масса эквивалента железа
(NH4)2Fe(SO4)2*6H2O= М (NH4)2Fe(SO4)2*6H2O, и соответственно молярная масса эквивалента железа  (
( )= М(
)= М( )
)
Вопрос2). Мольная рефракция. Расчет мольной рефракции: 1) по экспериментальным данным; 2) по правилу аддитивности.
Молекулярная рефракция — мера электронной поляризованости вещества, она имеет размерность объема, по порядку величины совпадает с объемом всех молекул в граммолекуле. Из этого следует, что порядок величины R должен совпадать с поправкой на объем в уравнении Ван-дер-Ваальса, что подтверждается значениями этих величин, получеными во время опытов
связывает молекулярную поляризуемость вещества с его показателем преломления n.

d — плотность вещества, M — его молекулярная масса.
Молярная рефракция зависит от состава и структуры вещества и обладает свойством аддитивности, т.е. может быть представлена в виде суммы: R = S xkRk.
Значения R для лучей видимой области спектра определяются в осн. поляризуемостью внешних (валентных) оболочек, так что возможны расчеты молярной рефракции на основе констант Rk, приписываемых хим. связям определенного типа и называемых рефракциями связей или связевыми рефракциями. Между атомными рефракциями, инкрементами и рефракциями связей существуют простые мат. соотношения, причем упомянутые аддитивные величины практически не имеют преимуществ друг перед другом. Они позволяют рассчитывать R с точностью до 0,3-0,4 мл/моль для молекул без эффектов сопряжения и с незначительно разветвленным углеродным скелетом. Наличие в молекулах сопряженныхкратных связей может приводить к весьма существенному (неск. мл/моль) превышению экспериментально определенного значения R по сравнению с вычисленным. Такое превышение называют экзальтацией P.M. и используют при установлении структурных ф-л орг. соединений. Постоянные Rk находят обработкой достаточно большого числа эксперим. данных по измерению лир для представителей разл. гомологич. рядов.
Молярную рефракцию определяют для подтверждения правильности установления элементного состава, выявления присутствия кратных связей и их сопряжения, идентификации геом. изомеров циклоалканов, анализа таутомеряых смесей. Корреляции R с др. физ.-хим. свойствами применяют для расчета ряда важных мол. параметров (дипольных моментов, энтальпий испарения и др.).
Весьма важным является то обстоятельство, что формула удельного лучепреломления, формула Лорентца—Лоренца

(где п — наблюденный показатель преломления, a d — плотность вещества при той же температуре), дает выражение удельной рефракции R, независимой от температуры, давления и агрегатного состояния вещества. Удельная рефракция является мерой действительного объемамолекулы. Произведение R × M называется молекулярной рефракцией.
Вопрос 3) Первый закон термодинамики.
Первый закон или первое начало термодинамики является частным выражением одного из основных законов природы - закона сохранения и превращения энергии, который гласит: энергия не создается из ничего и не превращается ни во что, а имеет место только взаимное превращение одного вида в другие в эквивалентных количествах.
Первое начало термодинамики было сформулировано в середине XIX века в результате работ немецкого учёного Ю. Р. Майера, английского физика Дж. П. Джоуля и немецкого физика Г. Гельмгольца[1]. Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника.
В соответствии с рекомендациями ИЮПАК для равновесного процесса в закрытой системепервое начало записывается в виде соотношения[4]
 Рассмотрим несколько частных случаев:
Если
Рассмотрим несколько частных случаев:
Если  , то это означает, что тепло к системе подводится.
Если , то это означает, что тепло к системе подводится.
Если  , аналогично — тепло отводится.
Если , аналогично — тепло отводится.
Если  , то система не обменивается теплом с окружающей средой и называется адиабатически изолированной.
Обобщая: в конечном процессе , то система не обменивается теплом с окружающей средой и называется адиабатически изолированной.
Обобщая: в конечном процессе  элементарные количества теплоты могут быть любого знака. Общее количество теплоты, которое мы назвали просто элементарные количества теплоты могут быть любого знака. Общее количество теплоты, которое мы назвали просто  — это алгебраическая сумма количеств теплоты, сообщаемых на всех участках этого процесса. В ходе процесса теплота может поступать в систему или уходить из неё разными способами.
При отсутствии работы над системой и потоков энергии-вещества, когда — это алгебраическая сумма количеств теплоты, сообщаемых на всех участках этого процесса. В ходе процесса теплота может поступать в систему или уходить из неё разными способами.
При отсутствии работы над системой и потоков энергии-вещества, когда  , ,  , ,  , выполнение системой работы , выполнение системой работы  приводит к тому, что приводит к тому, что  , и энергия системы , и энергия системы 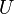 убывает. Поскольку запас внутренней энергии убывает. Поскольку запас внутренней энергии 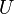 ограничен, то процесс, в котором система бесконечно долгое время выполняет работу без подвода энергии извне, невозможен, что запрещает существование вечных двигателей первого рода.
Первое начало термодинамики:
при изобарном процессе ограничен, то процесс, в котором система бесконечно долгое время выполняет работу без подвода энергии извне, невозможен, что запрещает существование вечных двигателей первого рода.
Первое начало термодинамики:
при изобарном процессе
 при изохорном процессе (
при изохорном процессе ( ) )
 при изотермическом процессе
при изотермическом процессе 
 Здесь
Здесь  — масса газа, — масса газа,  — молярная масса газа, — молярная масса газа,  — молярная теплоёмкость при постоянном объёме, — молярная теплоёмкость при постоянном объёме,  — давление, объём и температура газа соответственно, причём последнее равенство верно только для идеального газа. — давление, объём и температура газа соответственно, причём последнее равенство верно только для идеального газа.
|
Вопрос 4) Механизм каогуляции. Концентрационная и нейтрализационная каогуляция. Коагуляцией называется процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, так как частицы становятся слишком крупными и не могут участвовать в броуновском движении.
Коагуляция является самопроизвольным процессом, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.
Различают две стадии коагуляции.
1 стадия – скрытая коагуляция. На этой стадии частицы укрупняются, но еще не теряют своей седиментационной устойчивости.
2 стадия - явная коагуляция. На этой стадии частицы теряют свою седиментационную устойчивость. Если плотность частиц больше плотности дисперсионной среды, образуется осадок.
Нейтрализационная коагуляция происходит при добавлении к золю неиндифферентного электролита. При этом потенциалопределяющие ионы связываются в малорастворимое соединение, что приводит к уменьшению абсолютных величин термодинамического потенциала, а следовательно, и z-потенциала вплоть до нуля.
Если взять в качестве исходного только что рассмотренный золь хлорида серебра, то для нейтрализации потенциалопределяющих ионов Ag+ в золь необходимо ввести, например, хлорид калия. После добавления определённого количества этого неиндифферентного электролита мицелла будет иметь вид:

В системе не будет ионов, способных адсорбироваться на поверхности частицы AgCl, и поверхность станет электронейтральной. При столкновении таких частиц происходит коагуляция.
Так как причиной коагуляции в данном случае является нейтрализация потенциалопределяющих ионов, такую коагуляцию называют нейтрализационной коагуляцией.
Концентрационная коагуляция имеет место, когда она происходит под действием индифферентного электролита вследствие сжатия диффузного слоя противоионов и уменьшения абсолютного значения z-потенциала.
Рассмотрим концентрационную коагуляцию золя хлорида серебра, стабилизированного нитратом серебра, при введении в золь нитрата калия.
Формула мицеллы имеет вид: 
Билет№40
1.Способы выражения концентраций растворов (молярная концентрация эквивалентов, молярная концентрация, титр, поправочный коэффициент).
Если известны молярная концентрация эквивалента (нормальность) титранта C 2 и объем раствора V 2 в миллилитрах, израсходованный на титрование определяемого вещества, то количество вещества титранта, затраченное на реакцию, будет равно
 .
.
В точке эквивалентности количество вещества титранта, израсходованное на реакцию, будет точно равно количеству определяемого вещества в анализируемом растворе (n 1= n 2). Поэтому
 .
.
Масса m 1 определяемого вещества в анализируемом растворе рассчитывается по соотношению
 ,
,
где M э1 – молярная масса эквивалента определяемого вещества.
Если известен титр T 2 рабочего раствора, т.е. масса (г) растворенного вещества в 1 мл раствора, то количество вещества эквивалента титранта, вступившее в реакцию, составит
 .
.
Широко распространен в практике способ расчета результатов анализа с помощью условного титра рабочего раствора, или титра раствора по определяемому веществу T 2/1. Он показывает массу определяемого вещества, которая соответствует 1 мл рабочего раствора. Поэтому масса определяемого вещества может быть рассчитана очень простым образом
m 1= T 2/1 V 2 .
Если сравнить это выражение с предыдущей формулой расчета по титру рабочего раствора, то титр по определяемому веществу можно представить в виде
 .
.
С другой стороны, из формулы расчета массы определяемого вещества через молярную концентрацию эквивалента рабочего раствора следует, что
 .
.
Поправочный коэффициент определяют и рассчитывают следующим образом
 ,
,
где К- поправочный коэффициент;
пр- практическое значение;
т- теоретическое значение.


Вопрос 2. Естественный и поляризованный луч. Плоскость колебания и поляризации, угл вращения плоскости поляризации.
Испускание кванта света происходит в результате перехода электрона из возбужденного состояния в основное. Электромагнитная волна, испускаемая в результате этого перехода,является поперечной, то есть вектора  и
и  взаимно перпендикулярны и перпендикулярны направлению распространения. Колебания вектора
взаимно перпендикулярны и перпендикулярны направлению распространения. Колебания вектора  происходят в одной плоскости. Свет, в котором вектор
происходят в одной плоскости. Свет, в котором вектор  колеблется только в одном направлении, называется плоско поляризованным светом (или электромагнитной волной). Поляризованным называется свет, в котором направления колебания вектора
колеблется только в одном направлении, называется плоско поляризованным светом (или электромагнитной волной). Поляризованным называется свет, в котором направления колебания вектора  упорядочены каким-либо образом.
упорядочены каким-либо образом.
Свет представляет собой суммарное электромагнитное излучение множества атомов. Атомы излучают световые волна независимо друг от друга, поэтому световая волна, излучаемая телом в целом, характеризуется всевозможными равновероятными колебаниями светового вектора  . Свет со всевозможными равновероятными ориентациями вектора называется естественным. В плоско поляризованном свете плоскость, в которой колеблется вектор
. Свет со всевозможными равновероятными ориентациями вектора называется естественным. В плоско поляризованном свете плоскость, в которой колеблется вектор  , называется плоскостью поляризации, плоскость, в которой колеблется вектор
, называется плоскостью поляризации, плоскость, в которой колеблется вектор  , называется плоскостью колебаний.
, называется плоскостью колебаний.
Вектор  называют световым вектором потому, что при действии света на вещество основное значение имеет электрическая составляющая поля волны, действующая на электроны в атомах вещества.
называют световым вектором потому, что при действии света на вещество основное значение имеет электрическая составляющая поля волны, действующая на электроны в атомах вещества.
Угол поворота плоскости поляризации а линейно зависит от толщины слоя или концентрации и индивидуальных свойств оптически активного вещества. Угол поворота плоскости поляризации линейно зависит при прочих равных условиях от длины пробега волны в активной среде. Оптически активная среда, состоящая из смеси активных и неактивных молекул, поворачивает плоскость поляризации пропорционально концентрации оптически активного вещества, на чём основан поляриметрический метод измерения концентрации таких веществ в растворах; коэффициент пропорциональности, связывающий поворот плоскости поляризации с длиной луча и концентрацией вещества, называется удельным вращением данного вещества.
Вопрос 3.Электроды 1-го и 2-го рода,окислительно-восстановительные электроды.
Классификация электродов
Электроды первого рода
К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. в раствор либо из раствора в металл. Т.о., электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста
Электроды второго рода
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:

Окислительно-восстановительные электроды
в случае окислительно-восстановительных электродов процессы получения и отдачи электронов атомами или ионами происходят не на поверхности электрода, а только в растворе электролита Такой электрод, состоящий из инертного проводника первого рода, помещенного в раствор электролита, содержащего один элемент в различных степенях окисления, называется окислительно-восстановительным или редокс-электродом. Потенциал окислительно-восстановительного электрода также определяют относительно стандартного водородного электрода:
Pt, H2/ 2H+// Fe3+, Fe2+/ Pt
Знание величин электродных потенциалов позволяет определить возможность и направление самопроизвольного протекания любой окислительно-восстановительной реакции при одновременном наличии в растворе двух или более окислительно-восстановительных пар. Восстановленная форма любого элемента или иона будет восстанавливать окисленную форму другого элемента или иона, имеющего более положительный электродный потенциал.
Вопрос 4Образование двойного электрического слоя.Обьясните его по теории Гельмгольца- Перрена, Гуи-Чепмана, Штерна.
ОБРАЗОВАНИЕ ДЭС
Поверхность твердого тела приобретает ионы определенного знака. Эти ионы называют потенциалоопределяющими. К твердой поверхности из жидкой среды притягиваются ионы противоположного знака, их называют противоионами. Возникает ДЭС.
Было предложено несколько теорий образования ДЭС.
Простейшей из них является модель плоского конденсатора Гельмгольца-Перрена (5.1.а), согласно которой потенциалоопределяющие ионы и противоионы находятся на молекулярном расстоянии друг от друга, взаимодействие между ними осуществляется только за счет электростатических сил, а падение потенциала между слоями происходит линейно.

Рис. 5.1.
Дальнейшее развитие теория ДЭС получила в работах Гуи и Чепмена на основе сопоставления электростатического взаимодействия противоионов с энергией их теплового движения. Согласно модели Гуи и Чепмена противоионы рассматриваются как точечные заряды, не имеющие собственных размеров, расположенные в диффузном слое (5.1.б), а потенциал экспотенциально снижается по мере удаления от поверхности.
Согласно теории Штерна, которую можно рассматривать как основу современного представления о структуре ДЭС (5.1.в), противоионы находятся в двух положениях: одна их часть образует адсорбционный слой (иногда его называют плотным слоем или слоем Гельмгольца).Другая часть противоионов находится в диффузном слое. В отличии от адсорбционного слоя противоионы диффузного слоя не закреплены, в результате диффузии и взаимного отталкивания они способны перемещаться в пределах диффузного слоя в глубь жидкости.
ДЭС может возникнуть на частицах, находящихся в полярной среде, и в отсутствии электролитов, вследствие ориентации диполей, а также частичной поверхностной диссоциации полярных частиц, если в жидкой среде присутствуют хотя бы следы воды.
Потенциал, возникающий на границе между адсорбционным и диффузным слоем, называется потенциалом диффузного слоя д.
41 билет
1.Созревание осадка. Для каких осадков этот процесс характерен.
Созревание – это процесс укрупнения кристаллического осадка за счет растворения мелких кристаллов (старение). Время «созревания» осадка можно сократить, нагревая раствор с осадком.
«Созревание» по Оствальду заключается в растворении мелких кристаллов и упорядочении роста больших кристаллов. Термическое старение — упорядочение роста кристаллов под действием температуры. Химическое старение характерно для гидратов солей, например осадок оксалата кальция выпадает в виде смеси ди- и тригидрата, которые при повышении температуры переходят в моногидрат, при этом осадок самоочищается. В результате процесса старения образуется более чистый, крупнокристаллический, лучше фильтрующийся осадок с кристаллами более правильной формы.
2.Закон светопоглощения. Оптическая плотность и факторы влияющие на оптическою плотность
Зако́н Бугера — Ламберта — Бера — физический закон, определяющий ослабление параллельного монохроматического пучка света при распространении его в поглощающей среде.
Закон выражается следующей формулой:
 ,
,
где  — интенсивность входящего пучка,
— интенсивность входящего пучка,  — толщина слоя вещества, через которое проходит свет,
— толщина слоя вещества, через которое проходит свет,  — показатель поглощения (не путать с безразмерным показателем поглощения
— показатель поглощения (не путать с безразмерным показателем поглощения  , который связан с
, который связан с  формулой
формулой  , где
, где  — длина волны).
— длина волны).
Для растворов поглощающих веществ в непоглощающих свет растворителях показатель поглощения может быть записан как
 ,
,
где  — коэффициент, характеризующий взаимодействие молекулы поглощающего растворённого вещества со светом с длиной волны λ,
— коэффициент, характеризующий взаимодействие молекулы поглощающего растворённого вещества со светом с длиной волны λ,  — концентрация растворённого вещества, моль/л.
— концентрация растворённого вещества, моль/л.
Опти́ческая пло́тность — мера ослабления света прозрачными объектами (такими, как кристаллы, стекла, фотоплёнка) или отражения света непрозрачными объектами (такими, как фотография, металлы и т. д.).
Вычисляется как десятичный логарифм отношения потока излучения падающего на объект, к потоку излучения прошедшего через него (отразившегося от него), то есть это есть логарифм от величины, обратной к коэффициенту пропускания (отражения)[1]:

К примеру D=4 означает, что свет был ослаблен в 104=10 000 раз, то есть для человека это полностью чёрный объект, а D=0 означает, что свет прошёл (отразился) полностью.
В терминах оптической плотности задаются требования к выдержке негативов.
3. Перечислите все известные вам функции состояния.
Существует функция состояния термодинамической системы, называемая энергией. Эта функция имеет следующие свойства: при процессах,
происходящих в закрытых системах, сумма тепла Q, поглощенного системой из окружающей среды, и работы A, произведенной над системой, равна возрастанию энергии U системы.
∆U = Q + W (интегральная форма) Существует функция состояния термодинамической системы,
называемая энтропией S
Сформулируем два понятия, характеризующие механизм передачи энергии от системы к окружающей среде и в обратном направлении.
Теплота (тепло) Q - энергия, передающаяся за счет хаотического движения элементов системы и окружающей среды.
Работа W - энергия, передающаяся за счет упорядоченного поступательного движения потока большого числа элементов системы или окружающей среды.
Ни теплота, ни работа с точки зрения Первого начала термодинамики, не являются функциями состояния системы. Они зависят не только от параметров системы, но и от пути проведения процесса.
Внутренняя энергия системы U - это суммарная энергия всех составных частей системы и их взаимодействий.
Это кинетическая энергия хаотического теплового движения частиц системы, потенциальная энергия их взаимодействия, обусловленная структурой системы, энергия электронов на атомных и молекулярных орбиталях, энергия связи в атомных ядрах, энергия элементарных частиц.
энтальпия и обозначается H:
H=U+PV
Из проведенного анализа ясно, что:
QP =H
4. Поверхностно-активные вещества.
Вещества, добавление которых к растворителю уменьшает поверхностное натяжение, называют поверхностно-активными (ПАВ),
КЛАССИФИКАЦИЯ ПАВ

Анионные ПАВ - диссоцииируют в воде с образованием поверхностно-активного аниона. К ПАВ этого типа, составляющего большую часть мирового производства всех ПАВ относятся:
а) карбоновые кислоты и их соли;
б) алкилсульфаты;
в) фосфаты, тиосульфаты.
В качестве ПАВ широкое практическое применение находят соли синтетических жирных кислот.
В кислых средах соли карбоновых кислот переходят в слабодиссоциированные и малорастворимые кислоты, что резко снижает эффективность их действия, ухудшает их моющие свойства.
Катионные ПАВ диссоцииируют в воде с образованием поверхностно-активного катиона. К катионным ПАВ относятся соли первичных, вторичных и третичных алифатических и ароматических аминов.
Катионные ПАВ наиболее токсичные и наименее биологически разлагаемые из всех ПАВ, их часто используют в качестве бактерицидных, фунгицидных дезинфицирующих веществ, ингибиторов коррозии.
Амфолитные ПАВ содержат две функциональные группы. В зависимости от рН среды проявляют анионноактивные или катионноактивные свойства.
Неионногенные ПАВ не диссоциируют в растворах на ионы. Методы их получения основаны на реакции присоединения этиленоксида к спиртам, карбоновым кислотам, аминам и другим соединениям.
К недостаткам неионногенных ПАВ относится медленное разложение из-за наличия в их составе ароматического радикала и, как следствие, накопление их в объектах окружающей среды
Обычно свойства ПАВ характеризуют по отношению к воде. Все ПАВ по отношению к воде делятся на истинно растворимые и коллоидные.
К первой группе относится большой класс растворимых в воде дифильных органических соединений с небольшим углеводородным радикалом, например, низшие спирты, фенолы, кислоты и их соли - амины. Вещества этого типа находятся в растворе в молекулярно- дисперсном состоянии, применяют их в качестве смачивателей, вспенивателей, диспергаторов.
Особый интерес представляют коллоидные ПАВ. Главная отличительная особенность этих веществ - способность образовывать термодинамически устойчивые (лиофильные) гетерогенные дисперсные системы. Основные свойства коллоидных ПАВ: высокая поверхностная активность, способность к самопроизвольному мицеллообразованию, способность к солюбилизации - (резкому увеличению растворимости веществ в растворах коллоидных ПАВ вследствии их внедрения вглубь мицеллы), высокая способность стабилизировать дисперсные системы.
Билет
1.Расчетные формулы определения концентрации растворов, титра, массы анализируемого вещества по результатам титрования.
Растворы - это гомогенные (состоящие их одной фазы) системы, содержащие несколько компонентов. Растворы бывают газообразные, жидкие и твердые. Среди соединений (компонентов), образовавших раствор, выделяют растворенные вещества и растворитель.
Растворителем принято считать компонент, агрегатное состояние которого соответствует агрегатному состоянию раствора. Как правило, это компонент, содержание которого в растворе выше содержания остальных, которые называются растворенными веществами. Наибольшее практическое значение имеют жидкие растворы, в частности – водные растворы, в которых растворителем является вода.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества является его содержание в насыщенном растворе. Состав раствора и содержание растворенного вещества (концентрация) выражаются различными способами.
1. Массовая доля компонента w i - это отношение массы i- го компонента mi к массе раствора S mi: w i = mi / S mi, w i - безразмерная величина, принимающая значения от 0 до 1 или от 0 до 100% (в последнем случае говорят о процентной концентрации).
2. Молярная доля компонента Хi - это отношение числа молей i -го компонента ni к сумме молей å ni всех компонентов, образующих раствор, безразмерная величина: Хi = ni / å ni.
3. Моляльная концентрация растворенного вещества, или моляльность, Сm - число молей растворенного вещества n, приходящихся на 1 кг растворителя, моль/кг: Сm = n / ms =  , где m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль); ms - масса растворителя (кг).
, где m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль); ms - масса растворителя (кг).
4. Молярная концентрация растворенного вещества, или молярность, С - число молей растворенного вещества n в 1 л раствора, моль/л, или, сокращенно, М: С = n / V =  , где V - объем раствора (л); m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль).
, где V - объем раствора (л); m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль).
5. Молярная концентрация эквивалента растворенного вещества, или нормальная концентрация, или нормальность, С экв - число молей эквивалентов растворенного вещества n экв в 1 л раствора, моль экв/л, или, сокращенно, н.:
С экв= n экв/ V =  =
=  , где М экв – молярная масса эквивалента растворенного вещества (г/моль экв); z экв – число эквивалентности растворенного вещества; V - объем раствора (л); m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль).
, где М экв – молярная масса эквивалента растворенного вещества (г/моль экв); z экв – число эквивалентности растворенного вещества; V - объем раствора (л); m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль).
6. Массовая концентрация С масс – масса растворенного вещества m в 1 л раствор, С масс = m / V,где V - объем раствора (л).
Вопрос 2.Светопоглощение (А) светопропускание (Т). В каких пределах изменяются эти величины, их взаимосвязь.
Атом, ион или молекула, поглощая квант света, переходит в более высокое энергетическое состояние. Обычно это бывает переход с основного, невозбужденного уровня на один из более высоких, чаще всего на первый возбужденный уровень. Вследствие поглощения излучения при прохождении его через слой вещества интенсивность излучения уменьшается и тем больше, чем выше концентрация светопоглощающего вещества.
Закон Бугера - Ламберта – Бера (основной закон светопоглощения) связывает уменьшение интенсивности света, прошедшего через слой светопоглощающего вещества, с концентрацией вещества и толщиной слоя.
Уменьшение интенсивности света, прошедшего через раствор, характеризуется коэффициентом пропускания (или просто пропусканием) T:T= I / I0, где I и I0 — соответственно интенсивности света, прошедшего через раствор и растворитель.
Взятый с обратным знаком логарифм T называется оптической плотностью A:
-lg T= -lg (I / I0)=lg (I 0/ I)=A.
Уменьшение интенсивности света при прохождении его через раствор подчиняется закону Бугера-Ламберта-Бера: I=I0 10-e lc, или I / I0=10-e lc,или -lg T=A=e l c (1)
где e – молярный коэффициент поглощения; l – толщина светопоглощающего слоя; c – концентрация раствора.
Физический смысл e становится ясным, если принять I=1 см и c=1 моль/л, тогда A=e. Следовательно, молярный коэффициент поглощения равен оптической плотности одномолярног
 2018-01-21
2018-01-21 841
841









