| Дисперсионная среда | Дисперсная фаза | Название дисперсной системы | Примеры дисперсных систем |
| Газ | Жидкость | Аэрозоль | Туман,облака, карбюраторная смесь бензина с воздухом в двигателе автомобиля. |
| Твердое вещество | Аэрозоль | Дым, смог, пыль в воздухе | |
| Жидкость | Газ | Пена | Газированные напитки, взбитые сливки |
| Жидкость | Эмульсии | Молоко, майонез, жидкие среды организма (плазма крови, лимфа), жидкое содержимое клеток (цитоплазма, кариоплазма) | |
| Твердое вещество | Золь, суспензия | Речной и морской ил, строительные растворы, пасты. | |
| Твердое вещество | Газ | Твердая пена | Керамика, пенопласты, полиуретан, поролон, пористый шоколад. |
| Жидкость | Гель | Желе, желатин, косметические и медицинские средства (мази, тушь, помада) | |
| Твердое вещество | Твердый золь | Горные породы, цветные стекла, некоторые сплавы. |
Билет
Вопрос1 Условия осаждения аморфных осатков. Пример гравиметрического осаждения Fe(III). Аморфные осадки. В этом случае при осаждении происходит коагуляция первоначально образующегося коллоидного раствора. Для создания условий, способствующих коагуляции, необходимо по возможности нейтрализовать одноименные заряды коллоидных частиц, препятствующие их соединению. Для этого к раствору прибавляют какой-либо электролит, противоположно заряженные ионы которого, адсорбируясь на поверхности частиц, дают им возможность дальнейшей коагуляции. Другим фактором устойчивости коллоидных систем является сольватация (гидратация) коллоидных частиц, т.е. адсорбция ими молекул растворителя. В результате этого коллоидные частицы окружаются сольватными оболочками, препятствующими их соединению в более крупные агрегаты. Разрушение сольватных оболочек может быть достигнуто за счет добавления электролитов достаточно высокой концентрации. Ионы электролитов, сольватируясь, отнимают молекулы растворителя от коллоидных частиц, а также нейтрализуют заряды этих частиц, что способствует их коагуляции.Коагуляции способствует повышение температуры раствора. Оно уменьшает адсорбцию ионов и способствует разрушению сольватных оболочек частиц.
|
|
|
Таким образом, правила осаждения аморфных осадков следующие:
Проводить осаждение из концентрированного раствора концентрированным раствором осадителя.
Проводить осаждение из горячего раствора.
Проводить осаждение в присутствии подходящего электролита-коагулянта.
Аморфные осадки после осаждения сразу подвергают дальнейшим операциям: перенесению на фильтр и промыванию для предотвращения образования скрытокристаллической структуры при выдерживании под реакционным раствором.
|
|
|
При осаждении Fe(III) формой осаждения явл-ся Fe(OH)3, а при осаждении хлорила AgCl
FeCl3+3NH4OH→Fe(OH)3↓(осаждаемая форма)+3NH4CL
AgNO3+HCl→AgCl+HNO3
2Fe(OH)3→t○→Fe2O3+3H2O(гравиметрическая форма)
Вопрос2 Фотоэффект. Виды фотоэффекта. Фотоэлемент. Фотоэффе́кт, Фотоэлектрический эффект — испускание электронов веществом под действием света (или любого другогоэлектромагнитного излучения)Различают фотоэффект внешний, внутренний, вентильный и многофотонный фотоэффект. Внешним фотоэффектом называется испускание электронов веществом под действием электромагнитного излучения. Внешний фотоэффект наблюдается в твердых телах (металлах, полупроводниках, диэлектриках), а также в газах на отдельных атомах и молекулах (фотоионизация). Внутренний фотоэффект – это вызванные электромагнитным излучением переходы электронов внутри полупроводника или диэлектрика из связанных состояний в свободные без вылета наружу. В результате концентрация носителей тока внутри тела увеличивается, что приводит к возникновению фотопроводимости (повышению электропроводности полупроводника или диэлектрика при его освещении) или к возникновению электродвижущей силы (ЭДС). Вентильный фотоэффект является разновидностью внутреннего фотоэффекта, – это возникновение ЭДС (фото ЭДС) при освещении контакта двух разных полупроводников или полупроводника и металла (при отсутствии внешнего электрического поля). Вентильный фотоэффект открывает пути для прямого преобразования солнечной энергии в электрическую. Многофотонный фотоэффект возможен, если интенсивность света очень большая (например, при использовании лазерных пучков). При этом электрон, испускаемый металлом, может одновременно получить энергию не от одного, а от нескольких фотонов.
Фотоэлемент — электронный прибор, который преобразует энергию фотонов в электрическую энергию
Вопрос 3Молярная рефракция, в чем заключается аддитивность рефракции, и какое значение она имеет.
Молекулярная рефракция — мера электронной поляризованости вещества, она имеет размерность объема, по порядку величины совпадает с объемом всех молекул в граммолекуле. Из этого следует, что порядок величины R должен совпадать с поправкой на объем в уравнении Ван-дер-Ваальса, что подтверждается значениями этих величин, получеными во время опытов
связывает молекулярную поляризуемость вещества с его показателем преломления n.

d — плотность вещества, M — его молекулярная масса. Молекулярные рефракции соединений могут быть представлены аддитивно, т. е. как суммы рефракций составных частей молекулы (правило аддитивности). В качестве последних можно рассматривать связи или атомы (ионы). Подлинный физический смысл имеют рефракции связей, так как поляризуемое электронное облако в химическом соединении принадлежит связи, а не отдельным атомам. Для гомео- полярных соединений при расчетах чаще используют атомные рефракции, а при расчетах ионных соединений — ионные рефракции.
Аддитивность рефракций широко применяется как простой ненадежный способ проверки правильности предполагаемого строения молекулы. При этом поступают так: рассчитывают по правилу аддитивности теоретическое значение рефракции для каждой возможной структуры и сравнивают его с рефракцией данного вещества, найденной опытным путем. Для определения экспериментального значения  практически приходится находить лишь величины п и d в уравнении (II 1.2). Напри-
практически приходится находить лишь величины п и d в уравнении (II 1.2). Напри-
мор, опыт"™5 значение  диэтилсульфида равно 28,54, Теоретическое значение
диэтилсульфида равно 28,54, Теоретическое значение  рассчитывается исходя из предполагаемой структурной
рассчитывается исходя из предполагаемой структурной
(формулы

Используя величины рефракций связей (табл. 3), получим следую: щее значение 

|
|
|
Подсчет по атомным рефракциям также приводит к близкому результату:
4. Какие методы пептизации вы знаете, и как ее осуществляют
Вопрос 4Пептизацией называют переход осадков под действием пептизаторов в состояние коллоидного раствора. Пептизировать можно только «свежие» (свежеприготовленные) осадки, в которых частицы коллоидного размера соединены в более крупные агрегаты через прослойки ДС. По мере хранения осадков происходят явления рекристаллизации и старения, приводящие к сращиванию частиц друг с другом, что препятствует пептизации. Различают следующие виды пептизации: - адсорбционная; - диссолюционная; - пептизация промыванием осадка растворителем. 1) Получение золя бромида серебра адсорбционной пептизацией.
 Возьмем избыток AgNO3 (который играет роль пептизатора) и добавим его в раствор. В результате образуется золь, структурная единица дисперсной фазы которого называется мицеллой. Образование мицеллы происходит следующим образом. Ионы Ag+ (потенциалопределяюшие ионы) адсорбируются на поверхности частиц осадка AgBr, заряжая их положительно, к положительно заряженной поверхности образовавшегося ядра мицеллы притягиваются ионы противоположного знака – противоионы (ионы NO3-). Часть этих ионов, составляющая адсорбционный слой, прочно удерживается у поверхности ядра за счет электростатических и адсорбционных сил. Ядро вместе с адсорбционным слоем составляет коллоидную частицу. Остальные противоионы связаны с ядром только электростатическими силами. Эти противоионы образуют диффузный слой. Наличие заряда у коллоидных частиц приводит к их отталкиванию и обеспечивает устойчивость золя.
Возьмем избыток AgNO3 (который играет роль пептизатора) и добавим его в раствор. В результате образуется золь, структурная единица дисперсной фазы которого называется мицеллой. Образование мицеллы происходит следующим образом. Ионы Ag+ (потенциалопределяюшие ионы) адсорбируются на поверхности частиц осадка AgBr, заряжая их положительно, к положительно заряженной поверхности образовавшегося ядра мицеллы притягиваются ионы противоположного знака – противоионы (ионы NO3-). Часть этих ионов, составляющая адсорбционный слой, прочно удерживается у поверхности ядра за счет электростатических и адсорбционных сил. Ядро вместе с адсорбционным слоем составляет коллоидную частицу. Остальные противоионы связаны с ядром только электростатическими силами. Эти противоионы образуют диффузный слой. Наличие заряда у коллоидных частиц приводит к их отталкиванию и обеспечивает устойчивость золя.
 Как следует из рисунка и структурной формулы мицеллы, на поверхности твердых частиц осадка располагаются противоположные по знаку заряда ионы, которые пространственно разделены. Эти ионы образуют двойной электрический слой. Диссолюционная пептизация отличается от адсорбционной только отсутствием в готовом виде электролита-пептизатора. Рассмотрим на примере получения золя гидрооксида железа.
Как следует из рисунка и структурной формулы мицеллы, на поверхности твердых частиц осадка располагаются противоположные по знаку заряда ионы, которые пространственно разделены. Эти ионы образуют двойной электрический слой. Диссолюционная пептизация отличается от адсорбционной только отсутствием в готовом виде электролита-пептизатора. Рассмотрим на примере получения золя гидрооксида железа.
 К полученному осадку добавляем HCl: К полученному осадку добавляем HCl:
 Образовавшийся FeOCl является электролитом – пептизатором.Далее происходят такие же процессы, как и при адсорбционной пептизации с образованием мицелл: {[Fe(OH)3].nFeO+.(n-x)Cl-}x+.xCl-
Метод промывания осадка растворителем используется, если осадок получен при значительном избытке одного из реагентов. Большая концентрация ионов в растворе вызывает сжатие двойного электрического слоя. Ионы диффузного слоя проникают в адсорбционный, в результате заряд коллоидной частицы становится равным 0 и происходит агрегация частиц: {[mFe(OH)3].nFe3+.3nCl-}0 После промывания осадка растворителем мицеллы будут иметь вид:{[mFe(OH)3].nFe3+.3(n-x)Cl-}3x+.3xCl- Образовавшийся FeOCl является электролитом – пептизатором.Далее происходят такие же процессы, как и при адсорбционной пептизации с образованием мицелл: {[Fe(OH)3].nFeO+.(n-x)Cl-}x+.xCl-
Метод промывания осадка растворителем используется, если осадок получен при значительном избытке одного из реагентов. Большая концентрация ионов в растворе вызывает сжатие двойного электрического слоя. Ионы диффузного слоя проникают в адсорбционный, в результате заряд коллоидной частицы становится равным 0 и происходит агрегация частиц: {[mFe(OH)3].nFe3+.3nCl-}0 После промывания осадка растворителем мицеллы будут иметь вид:{[mFe(OH)3].nFe3+.3(n-x)Cl-}3x+.3xCl-
|

|
|
|
Совпадение значений Ям, полученных опытным и теоретическим путем, свидетельствует о правильности предположений структурной формулы диэтилсульфида
Билет
Вопрос 1Метод прямого перманганатометрического титрования, на примере определения железа (II) в соли Мора.
FeSO4*(NH4)2SO4*6H2O-наиболее устойчивое, соль Мора
10(NH4)2Fe(SO4)2*6H2O(сольМора)+2KMnO4(перманганат К)+8H2SO4=5Fe(SO4)3+2MnSO4+K2SO4+10(NH4)2SO4+8H2O
2 1 MnO4(-)+8H(+)+5F=Mn(2+)+4H2O
10 5 Fe(2+) –e=Fe(2+)
2MnO4+10Fe(2+)+16H=2Mn(2+)+10Fe(3+)+8H2O
Поскольку ион Fe(2+), переходя в ион Fe(3+), повышает степень окисления на единицу 1, то Мэкк=М, а r=1.
Вопрос 2Мольная рефракция. Расчет мольной рефракции: 1) по экспериментальным данным; 2) по правилу аддитивности.
Рефракция молярная (R) (от позднелат. refractio-преломление), произведение уд. рефракции г да мол. массу М: R = rМ. Уд. рефракция представляет собой отношение некоторой ф-ции f (n) показателя преломления л (см. Рефрактометрия) к плотности r вещества: r = f (n)/r. Величина г практически не зависит от температуры, давления и агрегатного состояния вещества. Из мн. предлагавшихся ф-ций f (n) наиб. распространение получила ф-ция Лоренца-Лоренца: f (n) = (n2 — 1)/(n 2 + + 2). Вычисленные с ее использованием значения R пропорциональны средней поляризуемости a молекул: R = (n2 — — 1) М /(n 2 + 2)r = 2,522•1024a. Простая пропорциональность между R и a является, однако, лишь первым приближением, поскольку вывод ф-ции Лоренца-Лоренца основан на упрощающих предположениях. Более строгие соотношения между n, r и a включают специфические для каждого вещества параметры (эффективные радиусы молекул, коэф. изотермич. сжимаемости) и позволяют объяснить изменения R при высоких давлениях и температурах, а также небольшие отклонения от аддитивности молярной рефракции растворов хим. соединений (см. ниже).
Молярная рефракция зависит от состава и структуры вещества и обладает свойством аддитивности, т.е. может быть представлена в виде суммы: R = S xkRk. В случае растворов xk- молярная доля k -гo компонента раствора с P.M. Rk; в случае хим. соединений xk- число фрагментов k -го вида с присущими им постоянными значениями Rk. Такими фрагментами м. б. ионы. атомы или атомные группировки; соответствующие им Rk называют ионными, атомными или групповыми рефракциями. Атомы одного элемента, но находящиеся в разных валентных состояниях или в разных функц. группах, имеют разл. значения Rk. Иногда необходимо вводить дополнит. слагаемые-инкременты рефракции циклов, двойных и тройных связей. например, инкременты связей С=С, С=С, трехчленного и четырехчленного углеродных циклов составляют соотв. 1,733, 2,398, 0,71 и 0,5.
Молярную рефракцию определяют для подтверждения правильности установления элементного состава, выявления присутствия кратных связей и их сопряжения, идентификации геом. изомеров циклоалканов, анализа таутомеряых смесей. Корреляции R с др. физ.-хим. свойствами применяют для расчета ряда важных мол. параметров (дипольных моментов, энтальпий испарения и др.).
Вопрос 3. Первый закон термодинамики. Основные понятия и определения
В термодинамике для правильного описания процесса очень важное значение имеет правильность применения той или иной терминологии, многочисленных термодинамических понятий. Поэтому необходимо с самого начала четко определить основные термины и понятия термодинамики. Мы будем пользоваться ими на протяжении всего курса физической химии.
Термодинамика - это наука, изучающая взаимные превращения различных видов энергии в зависимости от условий протекания процесса, а также возможность, направление и пределы самопроизвольного протекания процесса в рассматриваемых условиях. Она опирается на три фундаментальных закона, или начала, которые являются результатом обобщения практического опыта.
Химическая термодинамика - это та часть термодинамики, которая рассматривает применение законов термодинамики к химическим процессам и фазовым превращениям.
Система - в термодинамике системой называют тело или группу тел, состоящих из большого числа частиц и мысленно обособленных от окружающей среды. В зависимости от рассматриваемого явления система может быть различных размеров, но состоять она должна обязательно из большого числа частиц, так как только к макросистемам применимы такие понятия, как температура, давление, теплота и некоторые другие.
В зависимости от характера взаимодействия систем с окружающей средой их подразделяют на открытые, закрытые и изолированные.
Открытой называется система, которая может обмениваться с окружающей средой веществом и энергией.
Закрытой называется система, которая не обменивается с окружающей средой веществом, но она может обмениваться с ней энергией.
Изолированной называется система, объем которой остается постоянным и которая не обменивается с окружающей средой ни веществом, ни энергией. То есть исключается любое взаимодействие с окружающей средой. На практике абсолютная, полная изоляция системы от взаимодействия с окружающей средой не достижима. Понятие “изолированная система” - есть понятие идеальное (абстрактное), хотя на практике при определенных условиях этот термин применяют к реальным системам при термодинамических расчетах.
Адиабатически изолированная система - это система, в которой отсутствует теплообмен с окружающей средой.
Фаза - это часть системы с присущим ей химическим составом и макроскопическими свойствами. Иногда фазу определяют как часть системы, отделенную от других частей поверхностью раздела и механически отделимую от них. Это определение правильно, но только для непрерывных фаз. Если фаза прерывна (например, капли ртути на твердой поверхности), то второе определение не подходит. Все капли ртути в этом случае составляют одну фазу.
Гомогенной называется система, состоящая из одной фазы.
Гетерогенная - это система, состоящая из двух и более фаз.
Компонентами называются вещества, входящие в состав фаз.
Состояние системы - это совокупность физических и химических свойств, характеризующих систему.
Термодинамическими свойствами системы называют такие свойства, которые могут быть однозначно выражены через функции температуры, давления и концентрации веществ системы (это теплоемкость, внутренняя энергия, энтропия и т.п.). Термодинамические свойства системы взаимосвязаны. Изменение одного приводит к изменению остальных.
Для полного описания состояния системы достаточно знать некоторое наименьшее число термодинамических свойств, которые являются внутренними параметрами системами, это параметры состояния системы (температура, давление, объем, концентрации компонентов). Они связаны между собой уравнением состояния.
В общем виде уравнение состояния может быть записано следующим образом:
 (1.1)
(1.1)
где P, V, T, x, y - параметры состояния.
В качестве известного примера можно привести уравнение состояния “n” молей идеального газа, т.е. уравнение Менделеева - Клапейрона:
 (1.2)
(1.2)
Все свойства системы можно разделить на две группы:
* интенсивные - не зависящие от массы (это температура, давление, молярная теплоемкость, молярный объем) и
* экстенсивные - пропорциональные массе системы (это объем, энтропия, внутренняя энергия, теплоемкость системы).
Если в системе изменяется во времени хотя бы одно из термодинамических свойств, значит в системе протекает термодинамический процесс.
Вопрос 4Механизм каогуляции. Концентрационная и нейтрализационная каогуляция.. Механизм коагуляции.Устойчивость дисперсных систем обусловлена их лиофильностью, т.е. способностью притягивать растворитель в сольватные (гидратные) оболочки за счет молекулярного взаимодействия. Сольватные оболочки препятствуют слипанию частиц дисперсной фазы.
Для лиофобных золей, суспензий и эмульсий устойчивость в основном обусловлена зарядом на поверхности частиц дисперсной фазы (двойной электрический слой препятствует слипанию). Если частицы несут отрицательный заряд, то наиболее сильными коагулянтами являются многовалентные катионы, например: Fe3+,Al3+и др.
Положительно заряженные частицы коагулируются при давлении в раствор анионов.
Коагуляция растворов белков и др. биохимически активных веществ осуществляется за счет:
1. нагревания;
2. добавления солей тяжелых металлов;
3. нейтральных солей при высоких концентрациях (высаливание);
4. трихлоруксусной, сульфосалициловой кислотой;
5. танина и др. дубильных веществ;
6. органических растворителей (спирта, ацетона и др.).
При обработке поверхностных вод в качестве коагулянтов (реагентов для коагуляции) применяют:
1. сернокислый алюминий (глинозем)  ;
;
2. сернокислое железо (железный купорос)  ;
;
3. хлорное железо  ;
;
4. сернокислое оксидное железо  .
.
Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию.При коагуляции золя электролитами различают концентрационную и нейтрализационную коагуляцию.
Нейтрализационная коагуляция происходит при добавлении к золю неидифферентного электролита. При этом потенциалобразующие ионы связываются в малорастворимое соединение, что приводит к уменьшению по абсолютной величине термодинамического, а, следовательно, и электрокинетического потенциалов (рис. 31). Когда электрокинетический потенциал достигнет 30 мВ, начнется коагуляция и разрушение дисперсной системы.
Рассмотрим в качестве примера положительный золь гидроксида железа:
 .
.
При введении в золь неиндифферентного электролита КОН происходит нейтрализация потенциалопределяющих ионов Fe3+ ионами ОН– с образованием малорастворимого соединения Fe(OH)3. В результате снижается φ0-потенциал и z-потенциал, что приводит к ослаблению сил электростатического отталкивания. При снижении z до 30 мВ частицы слипаются, и происходит коагуляция.
Разновидность нейтрализационной коагуляции – взаимная коагуляция, которая возникает при смешении подобных золей с противоположными знаками зарядов.
Концентрационная коагуляция происходит под действием индифферентного электролита, при этом потеря устойчивости вызывается сжатием диффузной части ДЭС при неизменном потенциале ядра
Например, концентрационную коагуляцию положительного золя гидроксида железа

будет вызывать NaCl – индифферентный электролит по отношению к данному золю.
Скорость коагуляции зависит от концентрации электролита (рис. 42). Зона I – зона устойчивости; при |z| ³ 30 мВ система устойчива, силы электростатического отталкивания преобладают над силами притяжения, коагуляции не наблюдается и скорость ее равна нулю.
Билет
Вопрос 1Способы выражения концентраций растворов (молярная концентрация эквивалентов, молярная концентрация, титр, поправочный коэффициент).
Способы выражения концентраций растворов
Массовая доля вещества
Массовая доля обозначается греческой буквой "омега" и равна отношению массы растворенного вещества к общей массе раствора
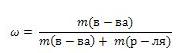
Выражают обычно в массовых долях или процентах (для этого в формуле правую часть домножают на 100%).
Молярная концентрация
показывает, сколько моль вещества содержится в 1 литре (1000 мл.) раствора. Обозначается См. Единица измерения - [моль/л] (часто пишут просто М)
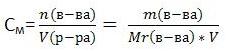 ,
,
где n - количество вещества в молях, V - объём раствора, m - масса вещества, Mr - молярная масса вещества.
Моляльная концентрация
число молей растворенного вещества в 1 килограмме (1000 г.) расторителя. Единица измерения - [моль/кг]
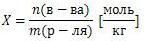
Нормальная концентрация
это число эквивалентов в 1 литре раствора. Обозначают символом Сн
 0,1 нормальный раствор - децинормальный.
0,1 нормальный раствор - децинормальный.
Титр
количество вещества (в граммах), растворённое в 1 мл. раствора. Различают титр по растворённому веществу (например, титр раствора соляной кислоты — THCl) или титр по определяемому веществу (например, титр раствора соляной кислоты по едкому натру — THCl/NaOH)
 ,где Т - титр в г/мл, Р - масса навески, V - объём мерной колбы.
,где Т - титр в г/мл, Р - масса навески, V - объём мерной колбы.
Вопрос 2 Естественный и поляризованный луч. Плоскость колебания и поляризации, угл вращения плоскости поляризации.
Естественный и поляризованный свет
Испускание кванта света происходит в результате перехода электрона из возбужденного состояния в основное. Электромагнитная волна, испускаемая в результате этого перехода, является поперечной, то есть вектора  и
и  взаимно перпендикулярны и перпендикулярны направлению распространения. Колебания вектора
взаимно перпендикулярны и перпендикулярны направлению распространения. Колебания вектора  происходят в одной плоскости. Свет, в котором вектор
происходят в одной плоскости. Свет, в котором вектор  колеблется только в одном направлении, называется плоско поляризованным светом (или электромагнитной волной).Поляризованным называется свет, в котором направления колебания вектора
колеблется только в одном направлении, называется плоско поляризованным светом (или электромагнитной волной).Поляризованным называется свет, в котором направления колебания вектора  упорядочены каким-либо образом.
упорядочены каким-либо образом.
Свет представляет собой суммарное электромагнитное излучение множества атомов. Атомы излучают световые волна независимо друг от друга, поэтому световая волна, излучаемая телом в целом, характеризуется всевозможными равновероятными колебаниями светового вектора  . Свет со всевозможными равновероятными ориентациями вектора называется естественным. Свет, в котором имеется преимущественное направление колебаний вектора
. Свет со всевозможными равновероятными ориентациями вектора называется естественным. Свет, в котором имеется преимущественное направление колебаний вектора  и незначительная амплитуда колебаний вектора
и незначительная амплитуда колебаний вектора  в других направлениях, называется частично поляризованным. В плоско поляризованном свете плоскость, в которой колеблется вектор
в других направлениях, называется частично поляризованным. В плоско поляризованном свете плоскость, в которой колеблется вектор  ,называется плоскостью поляризации, плоскость, в которой колеблется вектор
,называется плоскостью поляризации, плоскость, в которой колеблется вектор  , называется плоскостью колебаний.
, называется плоскостью колебаний.
Вектор  называют световым вектором потому, что при действии света на вещество основное значение имеет электрическая составляющая поля волны, действующая на электроны в атомах вещества.
называют световым вектором потому, что при действии света на вещество основное значение имеет электрическая составляющая поля волны, действующая на электроны в атомах вещества.
Различает также эллиптически поляризованный свет: при распространении электрически поляризованного света вектор  описывает эллипс, и циркулярно поляризованный свет (частный случай эллиптически поляризованного света) - вектор описывает окружность (сравните со сложением взаимно перпендикулярных колебаний: возможны: прямая линия, эллипс и окружность).
описывает эллипс, и циркулярно поляризованный свет (частный случай эллиптически поляризованного света) - вектор описывает окружность (сравните со сложением взаимно перпендикулярных колебаний: возможны: прямая линия, эллипс и окружность).

Вращение плоскости поляризации поперечной волны — физическое явление, заключающееся в повороте поляризационного вектора линейно-поляризованной поперечной волны вокруг её волнового вектора при прохождении волны через анизотропную среду. Волна может быть электромагнитной, акустической, гравитационнойи т. д.
Линейно-поляризованная поперечная волна может быть описана как суперпозиция двух циркулярно поляризованных волн с одинаковым волновым вектором и амплитудой. В изотропной среде проекции полевого вектора этих двух волн на плоскость поляризации колеблются синфазно, их сумма равна полевому вектору суммарной линейно-поляризованной волны. Если фазовая скорость циркулярно поляризованных волн в среде различна (циркулярная анизотропия среды, см. такжеДвойное лучепреломление), то одна из волн отстаёт от другой, что приводит к появлению разности фаз между колебаниями указанных проекций на выбранную плоскость. Эта разность фаз изменяется при распространении волны (в однородной среде — линейно растёт). Если повернуть плоскость поляризации вокруг волнового вектора на угол, равный половине разности фаз, то колебания проекций полевых векторов на неё будут вновь синфазны — повёрнутая плоскость будет плоскостью поляризации в данный момент.

Вращение плоскости поляризации электромагнитной волны в плазме при наложении магнитного поля (эффект Фарадея).
Таким образом, непосредственной причиной поворота плоскости поляризации является набег разности фаз между циркулярно поляризованными составляющими линейно-поляризованной волны при её распространении в циркулярно-анизотропной среде. Для электромагнитных колебаний такая среда называется оптически активной(или гиротропной), для упругих поперечных волн — акустически активной. Известен также поворот плоскости поляризации при отражении от анизотропной среды (см., например, магнитооптический эффект Керра).
Циркулярная анизотропия среды (и, соответственно, поворот плоскости поляризации распространяющейся в ней волны) может зависеть от наложенных на среду внешних полей (электрического, магнитного) и от механических напряжений (см. Фотоупругость). Кроме того, степень анизотропии и набег фаз, вообще говоря, могут зависеть от длины волны (дисперсия). Угол поворота плоскости поляризации линейно зависит при прочих равных условиях от длины пробега волны в активной среде. Оптически активная среда, состоящая из смеси активных и неактивных молекул, поворачивает плоскость поляризации пропорционально концентрации оптически активного вещества, на чём основан поляриметрический метод измерения концентрации таких веществ в растворах; коэффициент пропорциональности, связывающий поворот плоскости поляризации с длиной луча и концентрацией вещества, называется удельным вращением данного вещества.
Вопрос 3Электроды 1-го и 2-го рода,окислительно-восстановительные электроды.
Классификация электродов
По типу электродной реакции все электроды можно разделить на две группы (в отдельную группу выделяются окислительно-восстановительные электроды, которые будут рассмотрены особо в разделе 3.5.5).
Электроды первого рода
К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Т.о., электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста (III.40) с концентрацией катиона (к электродам первого рода относят также и водородный электрод).
 (III.40)
(III.40)
Электроды второго рода
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:

Окислительно-восстановительные электроды
В отличие от описанных электродных процессов в случае окислительно-восстановительных электродов процессы получения и отдачи электронов атомами или ионами происходят не на поверхности электрода, а только в растворе электролита. Если опустить платиновый (или другой инертный) электрод в раствор, содержащий двух- и трехзарядные ионы железа и соединить этот электрод проводником с другим электродом, то возможно либо восстановление ионов Fe3+ до Fe2+ за счет электронов, полученных от платины, либо окисление ионов Fe2+ до Fe3+ с передачей электронов платине. Сама платина в электродном процессе не участвуют, являясь лишь переносчиком электронов. Такой электрод, состоящий из инертного проводника первого рода, помещенного в раствор электролита, содержащего один элемент в различных степенях окисления, называется окислительно-восстановительным или редокс-электродом. Потенциал окислительно-восстановительного электрода также определяют относительно стандартного водородного электрода:
Pt, H2 / 2H+ // Fe3+, Fe2+ / Pt
Зависимость потенциала редокс-электрода εRO от концентрации (активности) окисленной [Ox] и восстановленной форм [Red] для окислительно-восстановительной реакции, в которой не участвуют никакие другие частицы, кроме окислителя и восстановителя, имеет следующий вид (здесь n – число электронов, участвующих в элементарном акте окислительно-восстановительной реакции):
 (III.54)
(III.54)
Из данного выражения следует уравнение для потенциала металлического электрода (III.40), т.к. активность атомов металла (восстановленной формы) в материале электрода равна единице.
Вопрос 4.Образование двойного электрического слоя.Обьясните его по теории Гельмгольца-Перрена, Гуи-Чепмана, Штерна.
Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциацииповерхностного соединения или ориентирования полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью, называются потенциалоопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами Согласно современным представлениям ДЭС это образ-ся на границе двух фаз тонкий поверхностный слой из пространственно разделенных электрических зарядов противоположного знака. ДЭС следует рассматривать как единую в целом нейтральную т.к сумма зарядов противоионов равна заряду тв.поверхности. В образовании ДЭС могут участвовать не только ионы, но и дипольные молекулы. Внешняя обкладка ДЭС состоит из 2х частей: плотной и диффузной. Теория диффузной части разработано и обосновано более полно, плотной части менее полно. Общая теория ДЭС пока отсутствует исторически в ходе изучения ДЭС было предложено несколько его моделей, которым отвечает различный х-р кривых падения потенциала и расположения противоионов.
Согласно простейшей модели Гельмгольца, ДЭС состоит из двух плоских слоев зарядов, расположенных на молекул.расстоянии один от другого и взаимодействующих между собой только за счет электростатических сил притяжения.такая структура подобна плоскому конденсатору, и падание потенциала между слоями происходит линейно. Модель Гуи Чепмена предполагает диффузное расположение противоионов,находящихся под действием сил, действующих в противоположных направлениях: электростатических сил притяжения к поверхности и сил теплового движения ионов, приводящих в диффузии и размыванию вншнего слоя ионов. Эта тория вводит понятие диффузного слоя, но ионы рассматриваются как точечные заряды, не имеющих обственных размеров. Теория учитывает специфическую адсорбцию противоионов, не обьясняет явл-е перезарядки и т.д.
Обобщающей явл-ся иеория Штерна. Согласно этой теории, часть противоионов нах-ся на молеклярном расстоянии отповерхности, образуя слой, подобный слою Гельмгольца. Другая часть противоинов имеет размытое расположение и образует диффузный слой.
Штерн ввел в теорию ДЭС предсталение о конечных размерах ионов их специфическую адсорбцию. Однако имеется ряд вопросов, не обьясняемых и теорией Штерна. Учение о ДЭС продолжает развиваться, т.к.оно имеет большое значение для понимания и усовершенствования таких практически важных процессов, как коагуляция коллоидов, флотация, ионный обмен.
Билет.
1)Процесс созревания осадка заключается в том, что более крупные кристаллики увеличиваются в размерах, а более мелкие постепенно уменьшаются и исчезают. Это объясняется тем, что растворимость мелких частичек данного вещества больше, чем крупных его частиц. Поэтому раствор, насыщенный в отношении мелких частиц является пересыщенным по отношению к более крупным частицам вещества. В результате этого наблюдается рост крупных частиц осадка за счет мелких.
вопрос2)В соответствии с основным законом колориметрии – законом Бугера-Ламберта-Бера- между поглощением излучения раствором и концентрацией в нем поглощенного вещества существует зависимость: l=lиндекс(0)*10в степени(-кlc)
Где, С- концентрация вещества, поглощающего свет, г-моль/л;
L- толщина слоя раствора, поглощающего свет, см;
K-молярный коэффициент погашения. Если светопоглощение раствора подчиняется закону Бугера-Ламберта-Бера, то оптическая плотность прямо пропорциональна концентрации вещества в растворе. Закон Бугера-Ламберта-Бера справедлив только для монохроматического излучения в средах с постоянным показателем преломления. При изменении концентрации вещества в растворе не должно происходить химических превращении. С изменением температуры молярный коэффициент погашения изменяется сравнительно мало.
вопрос 3)Функции состояния – термодинамические функции значения которых зависят только от состояния системы и не зависят от пути перехода между состояниями.
Функции состояния:
•Энергия•Температура
•Давление•Объем
•Плотность
вопрос 4) Поверхностно-активные вещества (ПАВ), вещества, адсорбция которых из жидкости на поверхности раздела с другой фазой (жидкой, твердой или газообразной) приводит к значит. понижению поверхностного натяжения (см. Поверхностная активность). В наиболее общем и важном с практической точки зрения случае адсорбирующиеся молекулы (ионы) ПАВ имеют дифильное строение, т. е. состоят из полярной группы и неполярного углеводородного радикала (дифильные молекулы). Поверхностной активностью в отношении неполярной фазы (газ, углеводородная жидкость, неполярная поверхность твердого тела) обладает углеводородный радикал, который выталкивается из полярной среды. В водном растворе ПАВ на границе с воздухом образуется адсорбционный мономолекулярный слой с углеводородными радикалами, ориентированными в сторону воздуха. По мере его насыщения молекулы (ионы) ПАВ, уплотняясь в поверхностном слое, располагаются перпендикулярно поверхности (нормальная ориентация).
Билет7
1.Расчетные формулы определения концентрации растворов, титра, массы анализируемого вещества по результатам титрования.
Растворы - это гомогенные (состоящие их одной фазы) системы, содержащие несколько компонентов. Растворы бывают газообразные, жидкие и твердые. Среди соединений (компонентов), образовавших раствор, выделяют растворенные вещества и растворитель.
Растворителем принято считать компонент, агрегатное состояние которого соответствует агрегатному состоянию раствора. Как правило, это компонент, содержание которого в растворе выше содержания остальных, которые называются растворенными веществами. Наибольшее практическое значение имеют жидкие растворы, в частности – водные растворы, в которых растворителем является вода.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества является его содержание в насыщенном растворе. Состав раствора и содержание растворенного вещества (концентрация) выражаются различными способами.
1. Массовая доля компонента w i - это отношение массы i- го компонента mi к массе раствора S mi: w i = mi / S mi, w i - безразмерная величина, принимающая значения от 0 до 1 или от 0 до 100% (в последнем случае говорят о процентной концентрации).
2. Молярная доля компонента Хi - это отношение числа молей i -го компонента ni к сумме молей å ni всех компонентов, образующих раствор, безразмерная величина: Хi = ni / å ni.
3. Моляльная концентрация растворенного вещества, или моляльность, Сm - число молей растворенного вещества n, приходящихся на 1 кг растворителя, моль/кг: Сm = n / ms =  , где m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль); ms - масса растворителя (кг).
, где m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль); ms - масса растворителя (кг).
4. Молярная концентрация растворенного вещества, или молярность, С - число молей растворенного вещества n в 1 л раствора, моль/л, или, сокращенно, М: С = n / V =  , где V - объем раствора (л); m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль).
, где V - объем раствора (л); m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль).
5. Молярная концентрация эквивалента растворенного вещества, или нормальная концентрация, или нормальность, С экв - число молей эквивалентов растворенного вещества n экв в 1 л раствора, моль экв/л, или, сокращенно, н.:
С экв= n экв/ V =  =
=  , где М экв – молярная масса эквивалента растворенного вещества (г/моль экв); z экв – число эквивалентности растворенного вещества; V - объем раствора (л); m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль).
, где М экв – молярная масса эквивалента растворенного вещества (г/моль экв); z экв – число эквивалентности растворенного вещества; V - объем раствора (л); m –масса растворенного вещества (г); М – молярная масса растворенного вещества (г/моль).
6. Массовая концентрация С масс – масса растворенного вещества m в 1 л раствор, С масс = m / V,где V - объем раствора (л).
Вопрос 2.Светопоглощение (А) светопропускание (Т). В каких пределах изменяются эти величины, их взаимосвязь.
Атом, ион или молекула, поглощая квант света, переходит в более высокое энергетическое состояние. Обычно это бывает переход с основного, невозбужденного уровня на один из более высоких, чаще всего на первый возбужденный уровень. Вследствие поглощения излучения при прохождении его через слой вещества интенсивность излучения уменьшается и тем больше, чем выше концентрация светопоглощающего вещества.
Закон Бугера - Ламберта – Бера (основной закон светопоглощения) связывает уменьшение интенсивности света, прошедшего через слой светопоглощающего вещества, с концентрацией вещества и толщиной слоя.
Уменьшение интенсивности света, прошедшего через раствор, характеризуется коэффициентом пропускания (или просто пропусканием) T:T= I / I0, где I и I0 — соответственно интенсивности света, прошедшего через раствор и растворитель.
Взятый с обратным знаком логарифм T называется оптической плотностью A:
-lg T= -lg (I / I0)=lg (I 0/ I)=A.
Уменьшение интенсивности света при прохождении его через раствор подчиняется закону Бугера-Ламберта-Бера: I=I0 10-e lc, или I / I0=10-e lc,или -lg T=A=e l c (1)
где e – молярный коэффициент поглощения; l – толщина светопоглощающего слоя; c – концентрация раствора.
Физический смысл e становится ясным, если принять I=1 см и c=1 моль/л, тогда A=e. Следовательно, молярный коэффициент поглощения равен оптической плотности одномолярного раствора при толщине слоя 1 см.
Оптическая плотность раствора, содержащего несколько окрашенных веществ, обладает, свойством аддитивности, которое иногда называютзаконом аддитивности светопоглощения.
Вопрос 3. Перечислите все известные вам функции состояния.
Фу́нкция состоя́ния — функция, определяющая состояние системы:
Термодинамическая функция состояния
Термодинами́ческая фу́нкция состоя́ния — в термодинамике некая функция, зависящая от нескольких независимых параметров, которые однозначно определяют состояние термодинамической системы. Значение термодинамической функции состояния зависит только от состояния термодинамической системы и не зависит от того, как система пришла в это состояние. Частным случаем функций состояний являются термодинамические потенциалы.
Функцией состояния называют любую термодинамическую величину, которая зависят только от текущего состояния системы и не зависят от того, каким путём система пришла в это состояние. В термин функция при этом вкладывают смысл, отличающийся от принятого в математике. С математической точки зрения одна и та же термодинамическая функция состояния может — в зависимости от ситуации — рассматриваться и как независимая переменная, и как функция других термодинамических величин, характеризующих состояние системы. К функциям состояния относятся, например: температура, давление, объём, теплоёмкость, энтропия, термодинамические потенциалы.
Вопрос 4. Молкулярно-кинетические свойства дисперсных систем. Диффузия, Броуновское движение. Осмотические давление.Седиментация.
Молекулярно- кинетическими называются свойства, которые обусловлены хаотическим тепловым движением частиц. Применительно к коллоидным растворам к этим свойствам следует отнести броуновское движение, диффузию и седиментацию.
Броуновское движение — беспорядочное, хаотичное движение коллоидно- и микроскопически-дисперсных частиц. Название дано по имени английского ученого Р. Броуна, открывшего это явление в 1827 г. Броуновское движение дисперсных частиц происходит вследствие непрерывного колебательного движения молекул дисперсионной среды. Интенсивность движения тем выше, чем больше температура, меньше вязкость среды и выше степень дисперсности.
Диффузия — самопроизвольный процесс перемещения вещества в результате беспорядочного теплового движения частиц, вследствие которого происходит выравнивание концентрации раствора. Скорость диффузии зависит от формы и размеров частиц, температуры и вязкости среды. Скорость диффузии коллоидных частиц меньше скорости диффузии частиц в истинных растворах.
Осмотическое давление коллоидных растворов значительно ниже, чем в истинных растворах той же концентрации. Объясняется это тем, что коллоидные частицы как по величине, так и по массе в огромное число раз больше обычных молекул. Вследствие этого и количество их в коллоидном растворе во столько же раз меньше, чем в молекулярном растворе, а осмотическое давление коллоидов пропорционально числу частиц в единице объема.
Седиментация — оседание (или всплывание) частиц в дисперсионной среде под действием гравитационного поля. Фактором, противодействующим седиментации, является диффузия, стремящаяся выравнять концентрации по всему объему. Действие гравитационных сил оказывается преобладающим лишь для более крупных частиц. Для мелких частиц скорость диффузии достаточна, чтобы предотвратить их оседание. Совокупное действие седиментации и диффузии приводит к установлению с течением времени седиментационного равновесия, характеризующегося постепенным уменьшением концентрации от нижних к верхним слоям раствора.
Билет.
1)метод отдельных навесок. Этот метод более точен. Для установки титра берут отдельные, близкие по величине навески установочного вещества(на титрование каждой из них должно расходоваться 20-25см2 стандартного раствора)и, растворив каждую из них в произвольном объеме воды, оттитровывают стандартным раствором. Расчетные формулы:
NA  ;
;  Где m- навеска установочного вещества; F – фактор пересчета или аналитический множитель;
Где m- навеска установочного вещества; F – фактор пересчета или аналитический множитель; 
Метод отдельных навесок состоит в том, что n навесок вещества (mo1, mo2 и т.д.), взятых на аналитических весах (г), растворяют в небольших объемах растворителя и проводят титрование каждого раствора. Метод пипетирования заключается в титровании порций раствора (аликвот Vх), отбираемых пипеткой из мерной колбы определенного объема (Vо), в которой растворена навеска анализируемого вещества, взятая на аналитических весах. Массу определяемого вещества (m) вычисляют по уравнении: m,г  (для прямого титрования), где Vт – среднее арифметическое из результатов параллельныхтитрований; Мэ – молярная масса эквивалента определяемого вещества. Коэффициент
(для прямого титрования), где Vт – среднее арифметическое из результатов параллельныхтитрований; Мэ – молярная масса эквивалента определяемого вещества. Коэффициент  вводят потому, что все объемы выражают в см3, а концентрация титранта Сэ,т выражена в моль эквивалентов /
вводят потому, что все объемы выражают в см3, а концентрация титранта Сэ,т выражена в моль эквивалентов /  . Для нахождения массовой доли определяемого вещества необходимо учесть массу навески mo:ω,%=
. Для нахождения массовой доли определяемого вещества необходимо учесть массу навески mo:ω,%=  100. Метод пипетирования более экспрессен и менее трудоемок, но и менее точен, чем метод отдельных навесок.
100. Метод пипетирования более экспрессен и менее трудоемок, но и менее точен, чем метод отдельных навесок.
вопрос 2) Оптически активные вещества подразделяются на два типа.
К первому типу относятся вещества, которые оптически активны лишь в кристаллической фазе (кварц, киноварь). Ко второму типу относятся вещества, которые оптически активны в любом агрегатном состоянии (например, сахара, камфора, винная кислота). У соединений первого типа оптическая активность является свойством кристалла как целого, но сами молекулы или ионы, составляющие кристалл, оптически неактивны. Кристаллы оптически активных веществ всегда существуют в двух формах - правой и левой; при этом решетка правого кристалла зеркально симметрична решетке левого кристалла и никакими поворотами и перемещениями левый и правый кристаллы не могут быть совмещены друг с другом. Оптическая активность правой и левой форм кристаллов имеет разные знаки и одинакова по абсолютной величине (при одинаковых внешних условиях). Правую и левую форму кристаллов называют оптическими антиподами.У соединений второго типа оптическая активность обусловлена диссимметрическим строением самих молекул. Если зеркальное отображение молекулы никакими вращениями и перемещениями не может быть наложено на оригинал, молекула оптически активна; если такое наложение осуществить удается, то молекула оптически неактивна. (Под зеркалом понимают отражатель, лежащий вне молекулы, и отражение дает отображение всей молекулы). Диcсимметрия есть нарушение максимальной симметрии объекта.Молекула бромхлофторметана (I) асимметрична, а молекула транс-1,2-дихлорциклопропана (I I) лишь диcсимметрична, т.к. имеет ось симметрии второго порядка (С2), но оба вещества оптически активны, т.к. не идентичны своим зеркальным отображениям.

Оптическая активность - это способность среды (кристаллов, растворов, паров вещества) вызывать вращение плоскости поляризации проходящего через нее оптического излучения (света). Впервые оптическая активность была обнаружена в 1811 г. Д.Араго в кристаллах кварца. В 1815 г. Ж.Био открыл оптическую активность чистых жидкостей (скипидара), а затем растворов и паров многих, главным образом органических веществ. Ж.Био установил, что поворот плоскости поляризации происходит либо по часовой стрелке, либо против нее, если посмотреть навстречу ходу лучей света и в соответствии с этим разделил оптически активные вещества на правовращающие (вращающие положительно, т.е. по часовой стрелке) и левовращающие (отрицательно вращающие) разновидности. Наблюдаемое значение угла поворота плоскости поляризации в случае раствора связано с толщиной образца (l) и концентрацией оптически активного вещества (С) следующей формулой:
j = [a ]. l. С
Коэффициент [a ] называется удельной оптической активностью или удельным вращением. Оптически активными веществами называют лишь те вещества, которые проявляют естественную оптическую активность. Теория вращения плоскости поляризации была разработана Френелем. Сущность ее сводится к следующему. Всякая плоскополяризованная волна может быть представлена как результат сложения двух волн, поляризованных по кругу, векторы Е которых вращаются с одной и той же угловой скоростью в противоположных направлениях. В оптически активной среде лучи, поляризованные по кругу, распространяются с различной скоростью. Поэтому возникает разность фаз β, которая зависит от толщины слоя оптически активного вещества d, периода колебания Т и скорости распространения волн v1 и v2 с правым и левым вращением: 
вопрос 3) АРРЕНИУСА УРАВНЕНИЕ, температурная зависимость константы скорости к элементарнойхим.р-ции:  . Аррениуса уравнение применимо к многим сложным р-циям; в этих случаях Еа обычно наз. кажущейся энергией активации. Для нек-рых сложных р-ций аррениусов график представляет собой кривую линию; если его используют для определения величин А и Еа, необходимо указывать соответствующие концентрационный и температурный интервалы.
. Аррениуса уравнение применимо к многим сложным р-циям; в этих случаях Еа обычно наз. кажущейся энергией активации. Для нек-рых сложных р-ций аррениусов график представляет собой кривую линию; если его используют для определения величин А и Еа, необходимо указывать соответствующие концентрационный и температурный интервалы.
Для нек-рых р-ций температурная зависимость к может быть представлена в виде Аррениуса уравнения лишь формально, с отрицат. значением Eа. Часто это указывает на то, что в совокупность элементарных процессов, определяющих р-цию, входит равновесная стадия, для к-рой температурная зависимость константы равновесия К выражается ур-нием:
 где
где  -стандартное изменение энтальпии р-ции, к-рое может принимать как положительные, так и отрицат. значения. Ур-ние было предложено С. Аррениусом в 1889.
-стандартное изменение энтальпии р-ции, к-рое может принимать как положительные, так и отрицат. значения. Ур-ние было предложено С. Аррениусом в 1889.
вопрос 4 ДИСПЕРСНЫЕ СИСТЕМЫ, гетерог. системы из двух или большего числа фаз с сильно развитой поверхностью раздела между ними. Обычно одна из фаз образует непрерывную дисперсионную среду, в объеме к-рой распределена дисперсная фаза (или неск. дисперсных фаз) в виде мелких кристаллов, твердых аморфных частиц, капель или пузырьков. Дисперсные системы могут иметь и более сложное строение, напр., представлять собой двухфазное образование, каждая из фаз к-рого, будучи непрерывной, проникает в объем др. фазы. К таким системам относятся твердые тела, пронизанные разветвленной системой каналов-пор, заполненных газом или жидкостью, нек-рые микрогетерогенные полимерные композиции и др. Нередки случаи, когда дисперсионная среда "вырождается" до тончайших слоев (пленок), разделяющих частицы дисперсной фазы.
Основные типы дисперсных систем. По дисперсности, т. е. размеру частиц дисперсной фазы или отношению общей площади межфазной пов-сти к объему (или массе) дисперсной фазы (уд. поверхности), дисперсные системы условно делят на грубодисперсные и тонко(высоко)дисперсные. Образование дисперсных систем. Возможно двумя путями: диспергационным и конденсационным. Устойчивость дисперсных систем характеризуется постоянством дисперсности (распределения частиц по размерам) и концентрации дисперсной фазы (числом частиц в единице объема).
Суспензии.Суспензии – это микрогетерогенные системы с твердой дисперсной фазой и жидкой дисперсионной средой.Суспензии отличаются от коллоидных растворов большим размером частиц. Частицы суспензий видны в микроскоп, они неспособны к броуновскому движению и диффузии, склонны к седиментации (осаждению под действием гравитационных сил), отделяются на фильтре. Суспензии не обнаруживают осмотического давления, поглощают и рассеивают свет не только при боковом освещении, но и в проходящем свете. Суспензии разрушаются при фильтрации, центрифугировании, коагуляции (при добавлении в систему коагулянтов - электролитов, вызывающих изменение поверхностного заряда частиц).
Эмульсии.Эмульсии – это дисперсные системы, состоящие из жидкой дисперсной фазы и жидкой дисперсионной среды.Условиями получения эмульсий является взаимная нерастворимость жидкостей и наличие стабилизатора (эмульгатора). Эмульсии тем седиментационно устойчивее, чем ближе плотности обеих фаз. Отличительной особенностью типичных эмульсий является сферическая форма частиц дисперсной фазы (капелек). Тип эмульсии легко определяется свойствами ее внешней фазы. Если эмульсия не смачивает гидрофобную поверхность, разбавляется водой, окрашивается при введении водорастворимого красителя, обнаруживает электропроводность – это эмульсия типа м/в, т.е дисперсионной средой является полярная жидкость (вода).
Пены.Пены представляют собой сравнительно весьма грубые, высококонцентрированные гетерогенные системы с газовой дисперсной фазой и жидкой дисперсионной средой.Пузырьки газа в таких системах имеют размер порядка миллиметров. Они представляют собой ячейки, стенки которых состоят из весьма тонких пленок жидкой дисперсионной среды. Пленки пены часто обнаруживают цвета интерференции; это свидетельствует о том, что их толщина соизмерима с длиной световых волн. Для пен не характерно броуновское движение. Устойчивые пены обладают некоторой жесткостью и механической прочностью, напоминая по своим свойствам высококонцентрированные эмульсии.Пены образуются только в присутствии стабилизаторов (пенообразователей). В качестве пенообразователей используют спирты, жирные кислоты, мыла и мылоподобные вещества, белки. Их назначение сводится к замедлению стекания жидкости.
Билет
1Условия осаждения кристаллических осадков. Пример осаждения бария из навески кристаллогидрата хлорида бария.
2Явление дисперсии в практике рефрактометрического анализа. Виды дисперсии.
3. Виды поляризации.Уравнения Клаузиуса-Массоти, Дебая, Лоренц-Лоренца.
4. Системы с твердой дисперсионной среды.
Вопрос 1)условия осождения кристалл-их осад-ов:1)из горяч раст-ра к горяч осадит-ям.2)при перемешивании и медлен прилевании осадителя.3)присоед-ние минерал кис –т(CH3COOH;HCL) Осадок оставляем на созревание «старение»-процесс укрупнения кристалл-го осадка засчет раст-ия мелких крис-ов.
Вопрос 2)Рефрактометрия- это раздел,в котором рассматриваются методы измерения показателя преломления света (n) при переходе из одной фазы в другую. дисперсия света – это зависимость показателя преломления вещества от частоты световой волны  . Области значения ν, в которых
. Области значения ν, в которых

|
соответствуют нормальной дисперсии света (с ростом частоты ν показатель преломления n увеличивается). Дисперсия называется аномальной, если

|
т.е. с ростом частоты ν показатель преломления n уменьшается.
Вопрос 3)В зависимости от механизма поляризации, поляризацию диэлектриков можно подразделить на следующие виды:
Электронная
Ионная
Дипольная (Ориентационная)
Электронно-релаксационная
Ионно-релаксационная
Структурная
Самопроизвольная (спонтанная)
Резонансная
Миграционная поляризация.
Фо́рмула Кла́узиуса — Моссо́тти: 
где  — молекулярная масса вещества,
— молекулярная масса вещества,  — его плотность, а
— его плотность, а  — постоянная Авогадро. В случае динамич. диэлектрич. проницаемости и чисто электронной поляризуемости для частот оптич.диапазона К.— М. ф. переходит в Лоренц— Лоренца формулу.
— постоянная Авогадро. В случае динамич. диэлектрич. проницаемости и чисто электронной поляризуемости для частот оптич.диапазона К.— М. ф. переходит в Лоренц— Лоренца формулу.
Фо́рмула Ло́ренца — Ло́ренца:  величину
величину  называют молекулярной рефракцией.
называют молекулярной рефракцией.
Вопрос 4)Коллоидные системы с твердой дисперсионной средой, или, как их часто называют, твердые золи так же как и лиозоли, можно разделить на системы с газовой, жидкой и твердой дисперсной фазой.
Системы с твердой дисперсионной средой и газовой дисперсной фазой — Г/Т часто называют твердыми пенами. Примером может служить пемза — пористая губчато-ноздреватая очень легкая горная порода вулканического происхождения,
Системы с твердой дисперсионной средой и жидкой дисперсной фазой — Ж/Т, которые по аналогии можно считать твердыми эмульсиями, встречаются довольно редко. Примером таких систем может служить так называемый черный фосфор, получающийся путем диспергирования металлической ртути в расплавленном фосфоре.
Наибольшее значение имеют системы Т/Т с твердой дисперсионной средой и твердой дисперсной фазой. К этому классу коллоидных и микрогетерогенных систем относятся некоторые окрашенные драгоценные и полудрагоценные камни, цветные стекла, эмали, многие минералы, горные породы, некоторые сплавы.
Коллоидные и микрогетерогенные системы с твердой дисперсионной средой обычно образуются методом конденсации из расплава.
Билет
Вопрос 1)Гравиметрия (весовой анализ) — метод количественного анализа в аналитической химии, который основан на измерении массы определяемого компонента, выделенном в виде веществ определённого состава.В гравиметрии есть три метода: отгонка, осаждение и выделение. Метод осажденияНавеску анализируемого вещества растворяют в воде или другом растворителе и осаждают определяемый элемент реактивом в виде малорастворимого соединения. Полученный осадок отфильтровывают, промывают, высушивают, прокаливают и взвешивают. Зная массу осадка, вычисляют содержание определяемого элемента в массовых долях или процентах от взятой навески.Поскольку осаждённое вещество может не соответствовать тому, что получается после прокаливания, различают осаждаемую и гравиметрическую форму осадка.
 2018-01-21
2018-01-21 1284
1284








