Донорно-акцепторная связь (ДАС) – разновидность ковалентной связи.
Выделяют соединения первого порядка (или валентно-насыщенные соединения) Пример: H2O, AgCl, NH3, HCl, KJ, CuSO4, FeCl3 и т.д. Реагируя друг с другом дают соединения высшего порядка (или комплексные соединения).
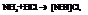
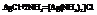
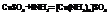
В комплексных соединениях проявляются ДАС. Рассмотрим пример:
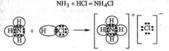
Азот в NH3 – донор, водород в HCl – акцептор.
Комплексное соединение – соединение высшего порядка, возникающее из соединений первого порядка без образования новых электронных пар, а за счет проявления хотя бы одной ДАС.
______________________________________
Рассмотрим пример [Cu(NH3)4]SO4.
Cu-комплексообразователь, 4-координационное число. ()- внутренняя сфера, [ ]-внешняя сфера, NH3-лиганды.
Координационное число для комплексного соединения имеет тот же смысл, что валентность в обычных соединениях. Принимает значения от 1-12 (кроме 10 и 11).
______________________________________
Предложено 2 теории возникновения комплексных соединений. Первая – Полинг – теория валентных связей.
Вторая – Бете – теория кристаллического поля.
|
|
|
Согласно первой, комлексообразователь, координирующий лиганды вокруг себя, имеет вакантные орбитали. Т.е. образование комплексных соединений – результат проявления ДАС,
Согласно второй, связь в комплексах – электростатическая, т.е. взаимодействие типа «ион-ион» или «ион-диполь».
_______________________________________
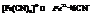
Константа равновесия (нестойкости) Кн:
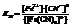
В квадратных и фигурной скобках концентрации ионов. Чем меньше значение Кн, тем более прочен комплексный ион.
 2018-01-21
2018-01-21 1302
1302








