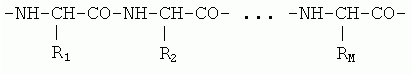
В основе белка лежит полимер — состоящая из аминокислотных остатков полипептидная цепь; это было установлено Э.Фишером в начале века. В начале 50-х годов Сэнгер показал, что белковая цепь имеет уникальную последовательность звеньев — аминокислотных остатков ("остаток" — это то, что осталось от свободной аминокислоты после ее встраивания в белковую цепь). Эта цепь имеет химически регулярный остов ("главную цепь"), от которого отходят разнообразные боковые группы аминокислот — радикалы R1, R2,..., RM
Есть двадцать основных аминокислотных остатков. Их положение в белковой цепи кодируется генами. Однако последующая модификация белка иногда увеличивает разнообразие аминокислот. Кроме того, в некоторые белки включаются разные кофакторы — малые молекулы, ионы, сахара, нуклеотиды, фрагменты нуклеиновых кислот и т.д. В ряде случаев они ковалентно пришиваются к определенным точкам цепи белка, но часто и просто специфически "прилипают" к белку. Белки "живут" в разном окружении, и их структура несет на себе явную печать этого окружения. Чем меньше воды вокруг белка, — тем невосполнимее разрыв мощных водородных связей, стягивающих его цепь, тем ценнее для белка эти связи (а именно они крепят структуру остова белковой молекулы), тем регулярнее вынуждена быть стабильная структура белка.
Грубо говоря, по "жизненным условиям" и общему типу строения белки можно разбить на три класса.
1) Фибриллярные белки образуют огромные агрегаты; их структура высоко регулярна и держится в основном взаимодействиями между разными цепями.
2) Мембранные белки "живут" в мембране, где нет воды, но части их выступают из мембраны в воду. Внутримембранные части таких белков — как и фибриллярные белки — высоко регулярны и прошиты водородными связями, но размер этих регулярных частей ограничен толщиной мембраны.
3) Водорастворимые, живущие в воде глобулярные белки наименее регулярны (особенно небольшие); их структура держится взаимодействиями белковой цепи с самой собой, причем особенно важны взаимодействия далеких по цепи, но сблизившихся в пространстве углеводородных (гидрофобных — "боящихся воды") групп, а также взаимодействиями белковой цепи с кофакторами.
Наконец, небольшие или бедные углеводородными группами полипептиды могут сами по себе не иметь фиксированной структуры, но приобретать ее при взаимодействии с другими макромолекулами.
Конечно, намеченное выше деление очень грубо. Порой белок может состоять из фибриллярного "хвоста" и глобулярной "головки" (так устроен, например, миозин), и так далее.
|
|
|
Нековалентные взаимодействия, поддерживающие пространственное строение белка, значительно слабее химических связей, фиксирующих последовательность мономеров — аминокислот — в белковой цепи. Эта последовательность — она называется "первичной структурой белка" (Рис.1-1) — создается в ходе матричного биохимического синтеза согласно "инструкции", записанной в гене. a-спирали часто изображаются спиральными лентами или цилиндрами, а вытянутые b-структурные участки (слипаясь, они образуют листы) — стрелками. Вторичные структуры отличаются регулярной, периодической формой главной цепи, — при разнообразии конформаций боковых групп.
Укладка вторичных структур одной полипептидной цепи в глобулу называется третичной структурой. Объединение же нескольких белковых цепей в "суперглобулу" называется четвертичной структурой белка.
|
|
|
 2018-02-13
2018-02-13 486
486








