Задание. Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения
C ® CO2 ® K2CO3 ® KHCO3® K2CO3
Решение:
C + O2® CO2(оксид углерода IV)
CO2 + 2KOH ® K2CO3(карбонат калия) + H2O
K2CO3 + H2CO3 ® 2KHCO3(гидрокарбонат калия)
KHCO3 + KOH ® K2CO3(карбонат калия)
Тема 3.
Химическая термодинамика
Задание 1. Для реакции MgCO3(K) = MgO(K) + CO2(Г) определите возможное направление самопроизвольного течения реакции при стандартных условиях и при температуре t =6270C, если тепловой эффект до заданной температуры не изменится.
Укажите: а) выделяется или поглощается энергия в ходе реакции; б) причину найденного изменения энтропии. Рассчитайте температуру, при которой устанавливается равновесие и происходит смена знака DG.
Решение:
В приложении 3 находим стандартные значения DHof и DSo для всех реагирующих веществ:
MgCO3(K) = MgO(K) + CO2(Г)
n, моль 1 1 1
| Вещество | DНf0, кДж/моль | S0, Дж/моль×К |
| MgCO3 | -1096,21 | 65,69 |
| MgO | -601,24 | 26,94 |
| CO2 | -393,51 | 213,6 |
По следствию из закона Гесса вычисляем DHor реакции:
|
|
|
DHor = DHo MgO(K) +DHo CO2(Г) – DHo MgCO3(K)
DHor = -601,24-393,51-(-1096,21) = 101,46 кДж
DHor > 0 - значит реакция является эндотермической, т.е. идет с поглощением теплоты.
По следствию из закона Гесса вычисляем DSo реакции:
DSor = So MgO(K) +So CO2(Г) – So MgCO3(K)
DSor = 26,94+213,6-65,69 = 174,85 Дж/К
DSo > 0 – энтропия возрастает, т. к. в ходе реакции образуются газообразные вещества.
Вычисляем энергию Гиббса при стандартных условиях, т.е. при температуре 298 К:
DGo = DHo - TDSo = 101,46-298*0,17485 = 49,36 кДж.
DGo > 0, следовательно реакция при Т=298 К невозможна.
Вычисляем энергию Гиббса при температуре t =6270C
DG = DHo - TDSo = 101,46 - (627 + 273)*0,17485 = -55,91 кДж.
DGo < 0, следовательно при t =6270C протекание реакции возможно.
Температура, при которой наступает равновесие:

Задание 2. Вычислите тепловой эффект реакции 4FeS2(K) + 11O2(Г) = 2Fe2O3(K) + 8SO2(Г) пользуясь стандартными энтальпиями образования реагирующих веществ (приложение 3). Сколько теплоты выделится (поглотится) при образовании вещества SO2 в количестве 89,6 л.?
Решение:
В приложении 3 находим стандартные значения DHof для всех реагирующих веществ:
4FeS2(K) + 11O2(Г) = 2Fe2O3(K) + 8SO2(Г)
n, моль 4 11 2 8
| Вещество | DНf0, кДж/моль |
| FeS2 (к) | -174,0 |
| O2 (г) | 0 |
| Fe2O3 (к) | -821,32 |
| SO2 (г) | -296,9 |
По второму следствию из закона Гесса рассчитываем тепловой эффект реакции образования 2 моль Cr:
DHor = (2DHor Fe2O3(K)+8DHor SO2(Г)) – (4DHor FeS2(K)+11DHor O2(Г))=
DHor = -821,32*2-296,9*8-(-174*4+11*0) = -3321,84 кДж
DHof<0 – реакция – экзотермическая, т.е. идет с выделением теплоты.
Находим количество вещества SO2, содержащееся в 89,6 л:
n(SO2)= 
Согласно уравнению реакции, при образовании 8 моль SO2 выделяется 3321.84 кДж теплоты, а при образовании 4 моль SO2:
|
|
|
DHof = 3321.84*4/8 = 1660.92 кДж
Тема 4.
Х имическая кинетика и химическое равновесие
Задание 1. Определите, как изменится скорость реакции 2СО(г) + О2(г) = 2СО2(г), когда прореагирует 40 % кислорода, если начальные концентрации реагирующих веществ равны, моль/л: Со(СO)=0,8, 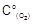 =0,6.
=0,6.
Решение:
Запишем выражение закона действия масс для данной реакции:
 .
.
1. Найдем скорость реакции в начальный момент времени
 .
.
2. Найдем количество прореагировавшего кислорода
 .
.
3. Найдем текущую концентрацию кислорода, т.е. в момент, когда прореагирует 40% О2
 .
.
4. Найдем количество прореагировавшего CO. В соответствии со стехиометрией реакции

5. Найдем текущую концентрацию CO
С(CO) = 0.8-0.48=0.32 моль/л.
6. Найдем текущую скорость реакции
n = k • 0.322 • 0.36 = 0,036864k.
7. Найдем, во сколько раз уменьшится скорость реакции, когда прореагирует 40% кислорода

Задание 2. Для обратимой реакции N2O4(г) = 2NO2(г) запишите выражение константы равновесия ΔН°, кДж = + 57. Предложите способы увеличения концентрации продуктов реакции
Решение:
Запишем уравнение для константы равновесия:
 .
.
Выход продуктов реакции (количество продуктов) увеличивается в том случае, если равновесие сместится «вправо».
По принципу Ле Шателье смещение равновесия «вправо» достигается следующими способами:
а) увеличением температуры, так как тепловой эффект реакции ∆H>0, т.е. реакция эндотермическая;
б) уменьшением давления, т.к. мольное количество газов в процессе реакции увеличивается
в) увеличением концентрации N2O4, а также снижением концентрации NO2.
Тема 5. Растворы
Задание 1. Вычислите молярную, нормальную концентрации и титр 10%-го раствора сульфата магния. Плотность раствора 1,103 г/мл.
Решение:
MgSO4
В 100 г раствора содержится 10 г соли, рассчитаем массу раствора:
V=m/ρ=100/1.103=90.7мл
Молярная концентрация раствора:

Так как эквивалент MgSO4 ½, то нормальная концентрация:
Сэк(MgSO4) = С(MgSO4)*2=0.9188*2=1.8376 н
Титр раствора:
Т=m/V=10/90.7 = 0.1103 г/мл
Задание 2. Составьте молекулярные и ионно-молекулярные уравнения реакций, протекающих в растворах между следующими веществами:
сульфатом меди (II) и соляной кислотой;
гидроксидом алюминия и гидроксидом калия;
сульфатом магния и карбонатом калия;
ацетатом свинца (II) и серной кислотой;
 2020-06-30
2020-06-30 635
635








