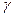Экспериментальное измерение молярных теплоёмкостей при постоянном давлении CP и при постоянном объёме CV затруднительно, проще измерить отношение этих величин g =CP/CV. Одним из самых простых методов определения CP/CV является методика с использованием адиабатического и изотермического процессов.
Таблица 1
| Молекула | Характер связи между атомами | Число степеней свободы |
|
| ||
| Пост. | Вр. | Кол. | ||||
| Одноатомная | - | 3 | - | - | 3 | 1,67 |
| Двухатомная | Жесткий | 3 | 2 | - | 5 | 1,40 |
| Двухатомная | Упругий | 3 | 2 | 1 | 7 | 1,29 |
| С числом атомов три и более | Жесткий | 3 | 3 | - | 6 | 1,33 |
Установка состоит из баллона A, соединённого с манометром B и насосом C (рис.3.1). С помощью крана 1 баллон может сообщаться с нагнетающим насосом, а с помощью крана 2 с окружающим воздухом. Если при помощи насоса накачать в баллон некоторое количество воздуха, то давление и температура воздуха внутри баллона повышаются.

|
|
|
Вследствие теплообмена с окружающей средой через некоторое время температура воздуха, находящегося в баллоне, сравнивается температурой внешней среды. Внутри баллона устанавливается давление
P1=P0+rgh1, (5)
где P0 - атмосферное давление, rgh1 - добавочное давление, измеряемое разностью уровней жидкостей h1 в манометре, r - плотность жидкости, g - ускорение свободного падения.
Таким образом, состояние воздуха внутри баллона, которое назовём состоянием 1, характеризуется параметрами P0+rgh1 , V1, T1. Если открыть на некоторое время кран 2, то процесс расширения газа можно считать адиабатическим.
Давление в сосуде установится равным атмосферному давлению P0, температура газа понизится до T2, а объём занимаемый газом равен
V2=V1+DV,
где DV - объём воздуха, вышедшего из баллона.

Следовательно, в конце адиабатического процесса 1 -2 параметры газа в состоянии 2 - P0, V2, T2. Применяя к состояниям 1 и 2 уравнение Пуассона, получим
 (6)
(6)
или
(V2/V1) g=(P0+rgh1)/P0 . (7)
Охладившийся при расширении воздух в баллоне и вне его через некоторое время вследствие теплопроводности нагревается до температуры внешней среды T1 (процесс 2-3); давление возрастает до величины
P2=P0+rgh,.
В состояниях 1 и 3 воздух имеет одну и ту же температуру (точки 1 и 3 лежат на одной изотерме). Поэтому можем применить закон Бойля-Мариотта.
|
|
|
(P0+rgh1)×V1=(P0+rgh2)V2. (8)
Возведя обе части уравнения (8) в степень g, получим
 . (9)
. (9)
Сравнение уравнений (7) и (9) дает
 . (10)
. (10)
Логарифмируя последнее выражение и решая полученное относительно g, находим:
 . (11)
. (11)
Давления P0, P0+rgh1, P0 +rgh2 мало отличаются друг от друга, поэтому разности логарифмов давлений можно считать пропорциональными разностям давленийи приближённо положить:
 (12)
(12)
Таким образом, экспериментальное определение CP/CV сводится к измерению высот h1 и h2.
 2020-09-24
2020-09-24 116
116