Сочетание кислотных и основных функциональных групп в молекуле ДНК делает ее достаточно чувствительной к рН среды и к присутствию в ней катионов металлов. Так, например, двухнитевая спираль устойчива только в среде с определенным содержанием ионов натрия и калия в достаточно узком интервале значений рН. В то же время ионы переходных металлов легко образуют комплексы с азотными функциями гетероциклических фрагментов молекулы ДНК, и поэтому они могут серьезно влиять на процессы репликации и транскрипции. Ионы металлов могут образовывать комплексы с ДНК как с участием воды (в гидратированной форме), так и без нее. Понятно, что включение в структуру ДНК дополнительных компонент нарушает естественный ход считывания информации с этой макромолекулы, что ведет к мутациям, то есть к изменению исходной структуры образовавшейся в результате репликации ДНК. В многоклеточном организме это может привести к появлению аномальных клеток, что лежит в основе тератогенного (отклонения в развитии плода) или онкогенного (возникновение злокачественных опухолей) эффекта ионов тяжелых металлов. В частности, установлено, что в присутствии повышенных концентраций ионов меди и марганца резко возрастает число мутантных клеток бактерий. Установлена канцерогенность солей хрома и никеля, токсичны соли кадмия, ртути, серебра, висмута. В отдельных случаях бактерицидные свойства таких солей (особенно серебра) используются для борьбы с патогенными микроорганизмами, хотя, конечно, токсическое действие этих металлов не ограничивается взаимодействием только с нуклеиновыми кислотами.
|
|
|
В полимерной молекуле ДНК, которая предназначена для длительного хранения информации, нет свободных гидроксильных групп. В отличие от этого молекула РНК достаточно легко деполимеризуется по реакции переэтерификации с образованием циклического фосфата:
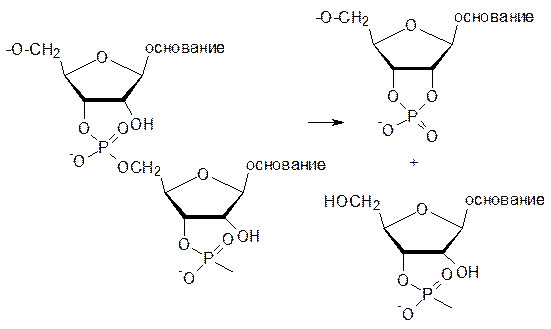
И все же, ионы меди, ртути, кадмия даже в очень низких концентрациях приводят к появлению разрывов в цепях ДНК из-за гидролиза. Еще более серьезные повреждения молекул наследственного вещества вызываются совместным действием ионов таких металлов и ионизирующего (или коротковолнового электромагнитного) излучения. Это особенно важно в связи с растущим загрязнением окружающей среды тяжелыми металлами на фоне радиоактивного заражения и возрастающей интенсивности ультрафиолетового излучения в результате разрушения озонового слоя. Свой вклад в этот процесс вносят и высокочастотные излучения различного происхождения (радиоволны дециметрового и более коротковолновых диапазонов, спутниковые и сотовые телефоны, печи СВЧ).
|
|
|
Постоянные повреждения структуры ДНК вызывает ультрафиолетовое и рентгеновское излучение, а также другие виды радиации. Известно, например, что УФ‑излучение вызывает димеризацию расположенных рядом тиминовых фрагментов в молекуле ДНК. Такое связывание приводит к изменению расстояния между основаниями и к сбою в рамке считывания:
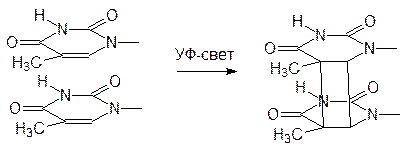
Природа готова к такому повреждению структуры ДНК: специальная ферментная система обнаруживает участки со связанными тиминовыми молекулами и вырезает их, вставляя «исправные». Если эта ферментная система дефектна (наследственное заболевание), то это проявляется в виде болезни ксеродермии, которая заставляет больных избегать солнечного света, сильно сушащего кожу и даже вызывающего злокачественные опухоли на коже.
В малой степени, но все же идет гидролиз образующихся в таутомерном превращении иминных функциональных групп в фрагментах цитозина и гуанина, в результате чего эти фрагменты превращаются, соответственно, в урациловый и ксантиновый. Превращение цитозинового остатка в урацильный по схеме:
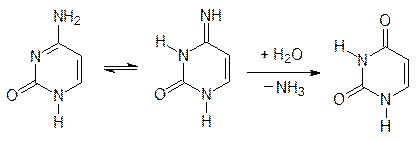
также распознается репарирующей ферментной системой (именно поэтому в молекуле ДНК роль урацила выполняет тимин). Если бы возможность такого распознавания была исключена, то урацил, образовавшийся из цитозина, оказался бы в аномальной паре с гуанином, и тогда репарирующая система встала бы перед неразрешимым вопросом: что надо заменить – урацил на цитозин или гуанин на аденин? Именно для таких исправлений возможных ошибок и служит вторая комплементарная нить ДНК. Кодирующая и комплементарная нити взаимно контролируют друг друга. Возможность саморепарации показана в опыте с культурой дрожжей: после облучения летальной для них дозой радиации некоторые дрожжевые клетки могут восстановить жизнеспособность, если их на несколько дней поместить в холодильник.
К химическим мутагенам относятся:
ü дезаминирующие вещества и N-нитрозопроизводные;
ü алкилаторы (диметилсульфат, метилиодид, метилбромид, бензилхлорид, азотистый и сернистый иприт, соединения с активированными двойными связями и т.д.);
ü структурные аналоги азотистых оснований и нуклеозидов.
На параметаболический процесс (химическое превращение без участия ферментов) гидролиза лактимной формы цитозинового, аденинового или гуанинового фрагментов может накладываться действие азотистой кислоты, образующейся, например, из нитратных удобрений или из добавляемых в мясные продукты нитратов и нитритов:
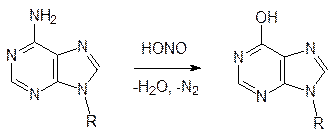
Пока число таких мутаций не превышает возможности их репарации соответствующими ферментными системами, контролирующими соответствие кодирующей и комплементарной нитей ДНК, отрицательные последствия минимальны. Если же ДНК с дезаминированными фрагментами включается в процесс транскрипции, то это приводит к фатальным последствиям, поэтому большие концентрации нитритов токсичны.
Важными мутагенами и цитостатиками (вещества, останавливающие деление клеток) являются все N-нитрозопроизводные и многие вещества с алкилирующей способностью. Так, например, одним из мощнейших мутагенов является N‑нитрозодиметиламин и другие нитрозамины, которые легко образуются из нитритов и вторичных аминов. N-Нитрозодиметиламин образуется также из несимметричного диметилгидразина, используемого в качестве ракетного топлива. N‑Нитрозопроизводные реагируют с аминогруппами в ДНК с образованием триазенов, например:
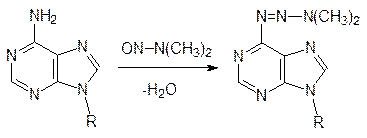
Среди алкилаторов можно выделить вещества, которые более или менее избирательны по отношению к различным нуклеофильным центрам (зарядовый и орбитальный контроль); есть С-алкилаторы, S-алкилаторы, N-алкилаторы, О‑алкилаторы. Так, например, диметилсульфат алкилирует преимущественно атом кислорода в гуаниновом фрагменте ДНК:
|
|
|
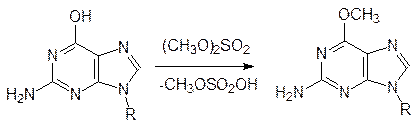
Алкилирование, конечно, приводит к изменению системы водородных связей в молекуле ДНК, хотя небольшие количества метилированных азотистых оснований обязательно присутствуют в ДНК. В отличие от этого азотистый иприт атакует атом азота в имидазольном цикле пуриновых оснований, что приводит к отщеплению азотистого основания:
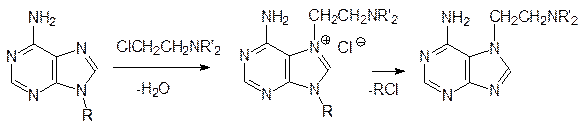
Первыми средствами для лечения злокачественных опухолей стали b‑хлорэтиламины. Их действие было направлено на клетки, которые часто делятся и система репарации которых не успевает заменить дефектные участки в ДНК, образовавшиеся в результате действия этих веществ. С этим механизмом действия связан и токсический эффект алкилаторов, так как в организме человека достаточно много нормальных тканей, в которых идет интенсивное деление клеток. Совершенствование структур b‑хлорэтиламинов улучшило их терапевтические показатели. В качестве примера можно привести современное химиотерапевтическое средство циклофосфан (циклофосфамид)
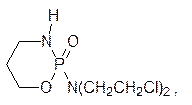
избирательность которого основана на гидролитическом отщеплении бис(b‑хлорэтил)амина от этого производного фосфорной кислоты. Алкилирующая способность хлорэтильных групп в амиде очень низка, а в злокачественных клетках очень активны ферменты, гидролизующие производные фосфорной кислоты (фосфорилазы), поэтому цитотоксичный бис(b‑хлорэтил)амин образуется преимущественно в клетках опухоли.
Химические мутагены третьего типа относятся к антиметаболитам – структурным аналогам естественных метаболитов. Одним из примеров может служить 5-фторурацил. Его применение в роли антибактериального препарата основано на том, что часто делящиеся, интенсивно размножающиеся клетки испытывают острую потребность в строительных элементах ДНК и РНК, а ферментные системы бактерий не столь совершенны, чтобы различать присутствие лишнего заместителя. Поэтому они чаще встраивают этот структурный аналог урацила или тимина в свои РНК или ДНК, которые оказываются в результате этого дефектными. Для повышения избирательности 5‑фторурацила его ацилируют короткой пептидной цепью из D -аминокислот. В организме человека нет ферментов для разложения таких пептидных связей, а в клетках бактерий они есть. В клетках человека такой ацилированный 5-фторурацил не изменяется и, в конце концов, выводится, а в клетках бактерий гидролиз идет и в результате выделяется 5‑фторурацил, приводящий к образованию дефектной ДНК.
|
|
|
Другими примерами антиметаболитов структурных элементов ДНК служат, в частности, 5-иодуридин, азидотимидин (лекарство от СПИДа), арабиноаденозин (антибиотик и лекарство от герпеса):
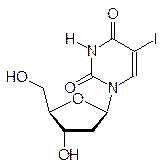
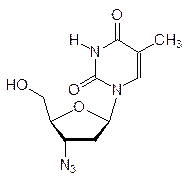
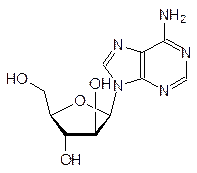
Антиметаболитами с противогерпесной активностью являются также ацикловир (Зовиракс) и ганцикловир:
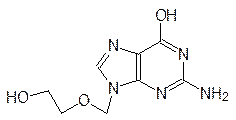
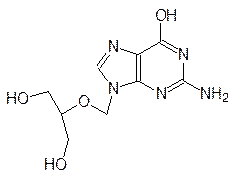
Для лечения лейкозов и лейкемий используются антибиотики цитарабин и пентостатин:
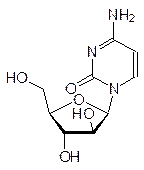
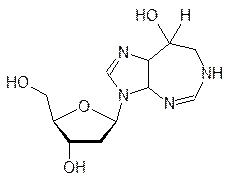
Особое место в нарушении репликации и транскрипции занимают вещества, называемые интеркаляторами. Дело в том, что несмотря на плотную упаковку молекулы ДНК в двойной спирали, в ней все же остается место для встраивания плоских молекул, и это, конечно, сопровождается изменением геометрии спирали, ее витки растягиваются, освобождая место для «квартиранта». Чем больше у внедрившейся в спираль ДНК молекулы возможностей для образования ионных, водородных или иных типов связей, тем более прочное соединение включения она образует.
Интеркаляторами являются многие полиядерные гетероциклические соединения, например 9-аминоакридин и этидийбромид:
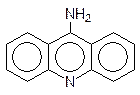
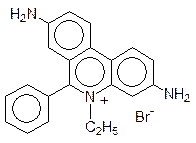
По механизму интеркаляции действуют также многие средства для борьбы с болезнетворными микроорганизмами. Например, типичным интеркалятором является алкалоид хинин, в течение многих лет использовавшийся для лечения малярии:
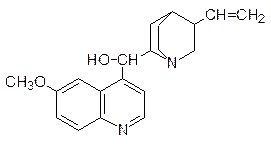
Интеркаляторами являются также синтетические аналоги хинина акрихин:
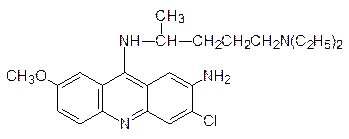
и хлорохин:
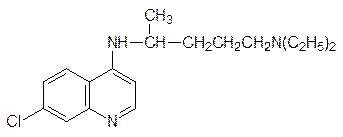
Большая группа интеркаляторных антибиотиков используется для лечения злокачественных новообразований. Так, например, рубомицин
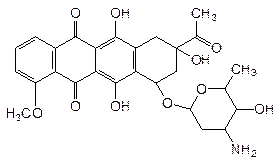
плоской системой четырех сконденсированных циклов встраивается между парами оснований в молекуле ДНК, а дидезоксиаминосахаридный фрагмент служит подобием якоря, фиксируясь в пространстве между полиэфирными цепями двух нитей ДНК с фосфатными группами.
 2020-10-10
2020-10-10 294
294








