Лекция 3.
Тема 1.1. Основные газовые законы (продолжение)
И законы газовых смесей.
Аннотация. Представлен аналитический вывод уравнения состояния идеального газа. Дана развернутая характеристика уравнения Клайперона – Менделеева. Дано пояснение физической сущности универсальной и удельной газовой постоянной.
Рассмотрены газовые смеси, способы задания их качественного состава и роль закона Дальтона в равновесных газовых смесях.
Показана связь (переход) между массовыми, объемными и мольными долями задания газовой смеси.
Приведены основные термодинамические параметры газовых смесей.
Уравнение состояния идеального газа. Объединенный газовый закон.
Законы Бойля - Мариотта, Гей-Люссака и Шарля устанавливают связь для данной массы газа только между двумя из трех основных параметров газаP, v и Т при условии, что значение третьего параметра остается постоянным. Уравнение состояния идеального газа устанавливает связь между всеми тремя основными его параметрами.
|
|
|
Допустим, что идеальный газ, заключенный в цилиндре с поршнем имеет параметры p 1, v 1 и T 1, (рис. 1, а). Если уменьшить давление газа в цилиндре и подвести к нему некоторое количество теплоты, то газ перейдет в новое состояние, где будут иметь место параметры р2, v2 и Т2 (рис. 1, б).

|
Рис.1. Иллюстрация уравнения состояния идеального газа
Чтобы установить связь между начальным и конечным состояниями газа, осуществим переход из первого состояния в последнее двумя промежуточными операциями. Сначала уменьшим давление газа от р 1 до р 2, поддерживая температуру T 1 постоянной, путем подвода теплоты к газу. Тогда газ окажется в промежуточном состоянии (рис. 1, в) и будет иметь параметры р 2, v 3 и T 1. Затем будем подогревать газ так, чтобы он продолжал расширяться, сохраняя свое давление неизменным, его температура при этом повысится до Т 2 (рис. 1, б).
Сопоставим эти три состояния газа. Так как в первом состоянии и третьем температуры одинаковы, то между удельными объемами и давлением газа в этих состояниях должна по закону Бойля—Мариотта существовать следующая связь:
 , (1)
, (1)
тогда
 (2)
(2)
Так как в третьем и втором состояниях давления одинаковы, то по закону Гей-Люссака
 (3)
(3)
откуда
 (4)
(4)
Тогда из рассмотренных формул (2) и (4)
 (5)
(5)
или, после преобразования формулы (5)
 . (6)
. (6)
Таким образом, отношения произведений давления на удельный объем к абсолютной температуре в любом состоянии газа равны между собой:
|
|
|
 (7)
(7)
Эту постоянную величину в уравнении (7) называют удельной газовой постоянной и обозначают буквой R.
Тогда уравнение (7) можно записать в виде:
 (8)
(8)
Уравнение (8) и называется уравнением состояния идеального газа, или объединенным газовым законом, получено французским физиком Б.Клапейрономв 1834 г. и носит его имя.
В это уравнение входит удельный объём v.
Клапейрон вывел это уравнение состояния идеального газа, объединив законы Бойля – Мариотта, Гей –Люссака и Шарля для данной массы газа.
Отдельные газовые законы являются частными случаями объединенного газового закона, если один из трех основных параметров состояния идеального газа (p, v, T) является неизменным.
Для использования уравнения Клапейрона необходимо определить численное значение удельной газовой постоянной для данного газа по справочным материалам. Для конкретного газа она будет иметь свое значение. Газовая постоянная становится универсальной, т. е. одинаковой для всех газов, если количество газа выразить в киломолях, что и сделал Д.И. Менделеев, записав уравнение Клапейрона для одного моля газа и использовал молярный объём Vμ:
 , (9)
, (9)
где Rμ — универсальная газовая постоянная.
Из следствия закона Авогадро нам известно, что при нормальных условиях (н.у.), т.е. t =0°С (273,15К) и давление 101325 Па =760 мм.рт.ст. моль идеального газа занимает объём 22,4 л, а кмоль – соответственно 22,4 м3.
Принимая во внимание это следствие, численное значение универсальной (молярной) газовой постоянной можно определить из формулы (9):
 , (10)
, (10)
 – универсальная газовая постоянная 1 Кмоля газа, для всех газов она имеет одинаковое значение и не зависит от состояния газа. С её помощью можно определить удельную газовую постоянную любого газа по формуле:
– универсальная газовая постоянная 1 Кмоля газа, для всех газов она имеет одинаковое значение и не зависит от состояния газа. С её помощью можно определить удельную газовую постоянную любого газа по формуле:
 , (11)
, (11)
где μ - молярная масса газа, т.е. масса 1 кмоля газа, выраженная в кг.
Из зависимости (11) можно понять физический смысл газовой постоянной: удельная газовая постоянная есть работа (в Дж), совершённая газом, массой 1 кг при изменении температуры на 1°С в изобарных условиях, т.е. при Р=const.
Уравнение Клапейрона – Менделеева можно записать для любой массы газа, вспомнив, что молярный объём V  в формуле (9) можно выразить через общий объём V и количество вещества n (молях)
в формуле (9) можно выразить через общий объём V и количество вещества n (молях)
 , (12)
, (12)
а  , (13)
, (13)
где m – масса газа;
Mr - молярная масса газа.
Тогда уравнение Клапейрона – Менделеева запишется в виде:
 , (14)
, (14)
 - универсальная газовая постоянная
- универсальная газовая постоянная
 – масса газа
– масса газа
 - молярная масса
- молярная масса
При постоянной массе уравнение (14) примет вид:  , уравнение состояния идеального газа.
, уравнение состояния идеального газа.
С помощью уравнения объединенного газового закона можно получить отдельные газовые законы, приняв массу газа и один из трех основных параметров состояния (абсолютное давление, абсолютная температура или удельный объём) – постоянными.
Если принять в уравнении (14)  и
и  , получим:
, получим:
 , (15)
, (15)
ибо в правой части уравнения (14) все составляющие являются постоянными величинами: 
Уравнение (15) есть не что иное, как математическая запись закона Бойля – Мариотта.
Аналогичным образом можно получить законы Гей – Люссака и Шарля, если примем  или
или  .
.
Если обобщить вышеизложенное, касательно уравнения состояния идеального газа, то получим следующее:
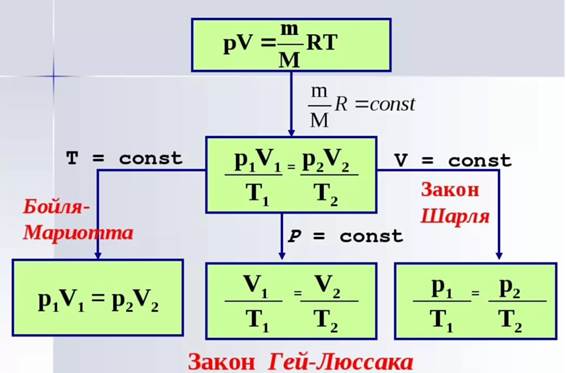
Рис.2 Объединенный газовый закон и отдельные газовые законы.
 2020-10-10
2020-10-10 1527
1527







