Массовая доля.
Наиболее простой способ определения состава газовой смеси – это определение массового состава смеси, т.е. для каждого газа находим его долю в общей массе смеси – массовую долю:
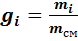 (18)
(18)
Очевидно, что 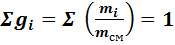 ,
,
т.е. 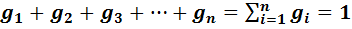
Молярная доля.
Можно найти и молярный состав смеси. Действительно, зная молярные массы, находим количество вещества каждого компонента
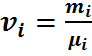 (19)
(19)
Следовательно, количество вещества в газовой смеси
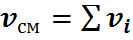 (20)
(20)
Имея эти данные, находим молярный состав смеси – молярные доли:
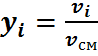 1)
1)
Молярную массу смеси можно определить следующим образом.
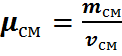 (22)
(22)
или
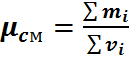 (23)
(23)
Полученное значение 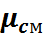 называется кажущейся, или условной, молярной массой смеси. Эта величина широко применяется в расчетах газовых смесей. Если известна (определена) молярная масса смеси, то можно найти удельную газовую постоянную смеси
называется кажущейся, или условной, молярной массой смеси. Эта величина широко применяется в расчетах газовых смесей. Если известна (определена) молярная масса смеси, то можно найти удельную газовую постоянную смеси 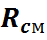 , используя уравнение (11), т.е.
, используя уравнение (11), т.е.
|
|
|
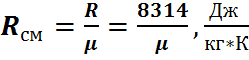 (24)
(24)
Объёмная доля.
Наиболее часто задается объемный состав смеси, поэтому необходимо ввести понятие о парциальном объёме компонентов.
Пусть имеется газовая смесь из двух компонентов. Если собрать молекулы одного газа в одной части объёма, а молекулы другого газа в другой части. Части объёма каждого газа и называются парциальными. Подбирая соответствующим образом доли от общего объёма, можно добиться того, что каждый газ достигает давления смеси. Объёмы, которые занимают эти газы, называют приведенными, т.е. приведенными к давлению смеси. Сумма приведенных объемов равна объёму смеси (закон Амага):
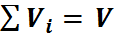 (25)
(25)
Отсюда может быть определен объёмный состав смеси, причем объёмная доля каждого компонента выражается отношением
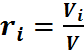 (26)
(26)
Так как каждый компонент смеси подвергается сжатию при постоянной температуре, то для 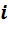 -го компонента смеси можно написать уравнение
-го компонента смеси можно написать уравнение
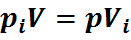 , - это следует из закона Бойля – Мариотта. (27)
, - это следует из закона Бойля – Мариотта. (27)
Здесь 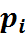 - парциальное давление
- парциальное давление 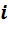 - го компонента смеси газа;
- го компонента смеси газа;
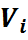 - приведенный или парциальный объём
- приведенный или парциальный объём 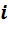 - го компонента смеси газа;
- го компонента смеси газа;
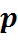 - давление смеси газа;
- давление смеси газа;
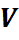 - объём смеси газа.
- объём смеси газа.
Из уравнения (27) следует:
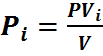 , (28)
, (28)
но 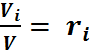 (26), тогда уравнение (28) запишем в виде:
(26), тогда уравнение (28) запишем в виде:
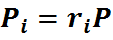 (29)
(29)
|
|
|
Эта формула позволяет определять парциальные давления компонентов смеси, если известен объёмный состав смеси.
Так как при одинаковых давлениях и температурах молярные объёмы газов одинаковы, то можно написать для 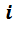 - го газа
- го газа
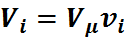 , (30)
, (30)
а для всей смеси
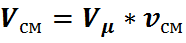 , (31)
, (31)
Из этих уравнений находим
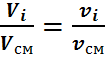 , (32)
, (32)
Следовательно, молярные доли численно равны объёмным:
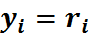 (33)
(33)
Связь между долями.
Массовые и объёмные (молярные) доли можно связать между собой, если известна плотность 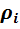 каждого компонента смеси. Тогда
каждого компонента смеси. Тогда
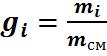 (34)
(34)
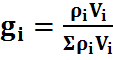 (35)
(35)
Для определенной газовой смеси массовые и объёмные доли 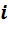 – го компонента смеси будут различны, ввиду разной плотности компонентов смеси.
– го компонента смеси будут различны, ввиду разной плотности компонентов смеси.
Из следствия 2 закона Авогадро известно, что плотности веществ зависят от их молярных (молекулярных) масс, т.е. они пропорциональны молярным массам.
Так, например, для сухого воздуха
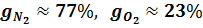 в массовых долях,
в массовых долях,
а в объёмных: 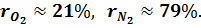
 2020-10-10
2020-10-10 966
966








