Таблица 47 - Дифференцирующие признаки видов рода Listeria
| Признаки | L. grayi | L. innocua | L. ivanovii | L. monocytogenes | L. murrayi | L. seeligeri | L. wells-himeri |
| Гемолизин | - | - | +1) | + 2) | - | + | - |
| САМР-тест (S. aures) | - | - | - | + | - | + | - |
| САМР-тест (R. equi) | - | - | + | - | - | - | - |
| Образование кислоты из маннита | + | - | - | - | + | - | - |
| L-метил-маннозида | + | - | + | - | + | ||
| L-рамнозы | - | - | + | d | - | D | |
| D-ксилозы | - | - | + | - | - | + | + |
| Гидролиз гиппурата | - | + | + | + | - | ||
| Восстановление нитрата | - | - | - | - | + | ||
| Патогенность для мышей | - | - | + | + | - | - | - |
Примечание к таблице 47
Пробел означает, что признак не исследован. Вид L. denitrificans перенесен в отдельный род Yonesia. 1) Обычно широкая зона или многочисленные зоны. 2) Некоторые штаммы отрицательные. Обозначения: «d» — 11-80% штаммов положительные.
Далее на газон с культурой бактериологической петлей наносят раздельно по одной капле бактериофагов и каплю стерильного бульона (контроль), отмечая карандашом зону каждого фага и контроля. Расстояние между каплями должно быть не менее 1 см. Посевы инкубируют при 22-23° С в течение 16-24 часов. В положительном случае на месте нанесения фага образуется прозрачная зона лизиса. Допускается наличие единичных колоний или сплошного нежного роста (вторичная культура) при интенсивном росте культуры на остальной площади питательной среды. Для достоверности результатов целесообразно проводить 2-3 параллельных исследования. Нелизируемые культуры идентифицируют по общим критериям.
Для обнаружения L. monocytogenes также рекомендуется реакция нарастания титра фага (РНФ).
Серологическая идентификация листерий. Идентификация листерий в РА. Листерий имеют О- и Н-антигены, которые могут встречаться в различных комбинациях. Известно не менее 16 сероваров L. monocytogenes, но большая часть случаев заболеваний связана с сероварами 48, 1/2а, 1/2в. Антигенная структура листерий представлена в таблице.
Распределение серотипов по видам рода Listeria следующее: L.monocytogenes — 1/2А, 1/2В, 1/2С, 3А, 3В, 3С, 4А, 4АВ, 4С, 4D, 4F, «7»; L. ivanovii -5; L. innocua -4AB, 6А, 6В; L. weishimeri -6A, 6B;
L. seeligeri -l/2B, 4С, 4D, 6В. Как видно, L. monocytogenes имеет одну или несколько антигенных детерминант, общих с другими видами листерий. В РФ диагностические лаборатории используют листериозные агглютинирующие сыворотки. Поливалентная сыворотка содержит антитела против антигенов Н — АВ и О — II, V, VI, VII, IX и агглютинирует все известные серовары листерий. Типовые сыворотки позволяют идентифицировать листерий 1-го серотипа, которые содержат антигены О — II, и 2-го серотипа, имеющего О-антигены V и VI. Серологическую идентификацию проводят в РА на стекле.
Идентифицируемую культуру выращивают на МПБ при 37° С в течение 24 часов, затем засевают на две пробирки скошенного МПА, выращивают при 18-20° С в течение 24-30 часов, смывают стерильным физиологическим раствором и устанавливают концентрацию приблизительно 10-15 млрд микробных клеток в 1 мл.
На первом этапе приготовленный антиген исследуют в РА на стекле с поливалентной сывороткой, смешивая каплю сыворотки и каплю антигена, сыворотки и физиологического раствора (контроль). Учет проводят в течение трех минут. При наличии спонтанной агглютинации антигена в контроле опыт повторяют с применением в качестве антигена 24-часовой бульонной культуры, выращенной при комнатной температуре. Для дальнейшего исследования берут культуры, давшие положительную РА, идентифицированные как листерии.
Таблица 48 - Антигенная структура L. monocytogenes,
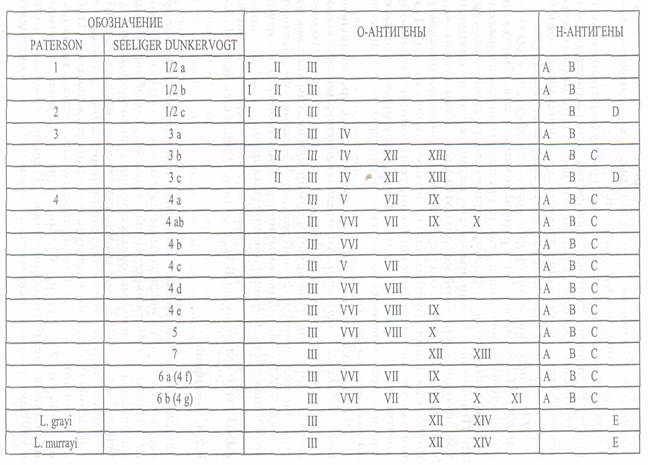
На втором этапе определяют серогруппу (серотип) культуры при помощи серогрупповых (типовых) сывороток 1-го и 2-го серотипов (серогрупп). Исследование проводят, как описано выше. По данным отечественных авторов абсолютное большинство изолированных штаммов листерии относятся к серотипу 1.
Идентификация листерии методом флуоресцирующих антител (МФА). Метод может быть использован как для обнаружения листерии в исследуемом материале, так и для идентификации выделенных культур. Используют флуоресцирующие сыворотки против сероваров 1,4а, 4b. Применяют, в зависимости от наличия флуоресцирующих сывороток, прямой и непрямой методы МФА. Из паренхиматозных органов готовят суспензию на физиологическом растворе 1:5, после осаждения крупных частиц из нее готовят мазки. Мазки из головного мозга, помимо фиксации спиртом, дополнительно обрабатывают ацетоном (2-3 раза по 5 минут) для удаления жировых компонентов, дающих неспецифическое свечение. Культуры листерии исследуют в 18-24-часовом возрасте.
Идентификация листерии также может быть проведена непрямым иммунопероксидазным методом. Антитела из диагностических сывороток в этом случае метят пероксидазой. Мазки готовят из головного мозга, паренхиматозных органов, фиксируют в химически чистом ацетоне, в качестве субстрата используют 0,05%-ный раствор 3,3-диаминобензидина тетрагидрохлорида (ДАВ).
Имеются сообщения об успешном использовании в диагностике листериоза ПЦР.
Биопроба. Заражение лабораторных животных применяют для обнаружения патогенных листерии в исследуемом материале, а также с целью определения патогенных свойств выделенных культур. Для обнаружения листерии в материале из паренхиматозных органов или головного мозга готовят суспензию и в дозе 0,3-0,5 мл вводят белым мышам массой 14-16 г (2-3 головы) подкожно или внутрибрюшинно. Внутримышечная инъекция кортизона (5 мг) повышает чувствительность животных. Наблюдение ведут в течение 10 суток. При положительных результатах гибель обычно наступает на 2-6 сутки, в большинстве случаев в паренхиматозных органах находят некротические очажки. Павших животных подвергают полному бактериологическому исследованию. С целью определения патогенных свойств выделенных культур также используют белых мышей, кроликов, морских свинок, куриные эмбрионы.
При титрации на мышах LД50 вирулентных штаммов листерии колеблется в пределах 10-1000 м.к. Заражение в желточный мешок 10-дневных куриных эмбрионов культуры в дозе 10 м.к. приводит к их гибели в течение 2-5 дней. Биопроба на кроликах с параллельным контролем количества моноцитов позволяет дать оценку специфичности результата опыта. Количество моноцитов в положительных случаях увеличивается в несколько раз. Кроликов заражают внутривенно в дозе 0,5-1 млрд м.к. Срок наблюдения — 14 суток. Для дифференциации патогенных культур листерии от возбудителя рожи также проводят копъюктивальную пробу на морских свинках или кроликах (Anton's-тест). На конъюктиву глаза морской свинки или кролика наносят две капли бульонной культуры. В положительном случае через 24-96 часов развивается гнойный конъюктивит, Е. rhusiopathiae такую патологию не вызывает.
Серологическая диагностика. Исследуют животных, подозреваемых в заболевании листериозом, а также животных из групп, где диагноз на листериоз уже установлен. Применяют пробирочную РА, РНГА и РСК. Серологические исследования дополняют другие методы диагностики листериоза и позволяют обнаружить переболевших, скрытых больных, бактерионосителей. Особенностью отечественной серологической диагностики является то, что серовары с 1/2а по 3с, используемые в международной классификации, объединены в первую серогруппу, а остальные — во вторую.
В РА используют антигены 1-го и 2-го сероваров в соответствии с наставлением по их применению. В качестве контрольных применяют соответствующие позитивные (1-й и 2-й серовар) сыворотки. Сыворотки исследуют параллельно с двумя указанными антигенами. РА ставят в объеме 1 мл с сыворотками крови крупного рогатого скота в разведениях 1:160-1:320; коз, овец, свиней — 1:80-1:160; кроликов — 1:20-1:40. РА с контрольной позитивной сывороткой ставят в разведениях до ее предельного титра, с контрольной негативной — в тех же разведениях, что и с исследуемыми сыворотками. Кроме того, ставят контроль каждого антигена с физиологическим раствором. Пробирки выдерживают при 37° С в течение 18-20 часов, затем 2 часа при комнатной температуре и учитывают результат. За положительный результат принимают положительные показания РА у крупного рогатого скота и лошадей в титре 1:320; овец, свиней, коз — 1:160; кроликов — 1:40. Отрицательные сыворотки рекомендуется исследовать дополнительно после обработки 2-меркаптоэтанолом (2-МЭ) или солянокислым цистенном. После такой обработки ставят РА по вышеизложенной схеме и за положительный результат у крупного рогатого скота и лошадей принимают титры 1:40; овец, коз и свиней — 1:20; кроликов — 1:10.
Обработка сывороток 2-МЭ. 2-меркаптоэтанол разводят до титра в соответствии с указанием на этикетке. Сыворотки крови разводят физиологическим раствором: крупного рогатого скота и лошадей — 1:20; овец, коз, свиней — 1:10; кроликов — 1:5. К 1 см разведенной сыворотки добавляют 1-2 капли раствора 2-МЭ, пробирки закрывают резиновыми пробками и выдерживают 60 минут в водяной бане при 37° С. После этого исследуют в РА сыворотки крови крупного рогатого скота и лошадей в разведении 1:40; овец, коз, свиней — 1:20; кроликов — 1:10. Обработка сывороток солянокислым цистеином. Растворяют 35,1 мг цистеина в 1 мл 0,2 М NaOH. Сыворотки крови крупного рогатого скота и лошадей разводят физиологическим раствором 1:10; овец, коз, свиней — 1:5; кроликов — 1:2,5. К 0,5 мл цистеина, пробирки закрывают резиновыми пробками и выдерживают при 37° С в течение 18-20 часов. Затем исследуют сыворотки крупного рогатого скота и лошадей в разведении 1:40; овец, коз, свиней — 1:20; кроликов — 1:10. Для исследования сывороток крови в РСК используют листериозный антиген для РСК, реакцию ставят в объеме 1 мл. Для контроля используют позитивные листериозные сыворотки и негативные исследуемого вида животного. Комплемент в бактериологической системе титруют в присутствии инактивированных сывороток (1:10) того вида животных, который исследуют. Режим инактивации сывороток:
30 минут при 56-57° С сыворотки крупного рогатого скота и свиней, лошадей и овец — при 58-59° С, кроликов при — 60° С. Реакцию считают положительной при задержке гемолиза на 3-4 креста, сомнительной — на 2 креста. Сыворотки крови от сомнительно реагирующих животных исследуют повторно через 2-3 недели.
Реакция связывания комплемента. Используют листериозный антиген ВНИИ ветеринарной вирусологии и микробиологии для исследования сыворотки крови всех видов животных. РСК ставят в объеме 2,5 мл по стереотипной схеме с сыворотками, разведенными 1:10. Для контроля применяют нормальные сыворотки крови от заведомо здоровых животных и позитивные от переболевших листериозом животных. Первую фазу РСК проводят при 37-38° С в течение 20 минут, вторую также при 37-38° С 20 минут. Учет результатов проводят сразу после изъятия пробирок из водяной бани и окончательно через 14-18 часов выдерживания проб при комнатной температуре. За положительный результат принимают задержку гемолиза на три-четыре креста, сомнительный — задержку гемолиза на один-два креста. Сыворотки крови животных, давших сомнительную РСК, исследуют повторно через 2-3 недели и при получении задержки гемолиза не менее чем на два креста результат оценивается положительно.
При постановке РНГА используют диагностикум Омского НИИ природноочаговых болезней.
Питательные среды. Оптимальными питательными средами для выделения листерий считаются МПА или печеночный агар и МПБ с 1% глюкозы и 2-3% глицерина (рН 7,2-7,4), а также кровяной агар. В случае необходимости для первичного выделения листерий используют питательные среды, содержащие вещества, ингибирующие рост сопутствующей микрофлоры.
Среда с теллуритом калия. В 1000 мл расплавленного МПА (рН 7,2) добавляют 10 мл 2%-ного водно-глицеринового раствора теллурита калия и 50-100 мл стерильной сыворотки крови крупного рогатого скота. Компоненты перемешивают и среду сливают в чашки Петри. Питательная среда обладает элективными свойствами по отношению к L. monocytogenes.
Среда с теллуритом калия, полимиксином, флоримицином. В 1000 мл расплавленного МПА (рН 7,2-7,4) добавляют 10 см 2%-ного водно-глицеринового раствора теллурита калия, 0,3-0,5 мл раствора флоримицина или полимиксина (500 тыс. ЕД препарата разводят в 10 мл физиологического раствора). Листерий восстанавливают теллурит калия до металлического теллура, благодаря чему их колонии приобретают черный цвет. При исследовании растительных субстратов рекомендуется использовать МПА с 0,0035% трипафлавина и 0,001% налидиксовой кислоты, а также МПБ с 3,75% калия родонистого и МПБ с 10% натрия хлорида.
Среда с ацетатом калия и налидиксовой кислотой. Питательный бульон (Оксоид), содержащий: глюкоза — 0,2%; таллия ацетат — 0,2%; налидиксовая кислота — 40 мкг/мл. Кристаллическую налидиксовую кислоту (0,05 г) растворяют в 0,5 мл 1N NaOH, после растворения добавляют 4,5 мл дистиллированной воды, после чего вносят до необходимой концентрации в среду. Стерилизуют при 121° С в течение 15 минут.
Бульон для листерий с KCNS. Пептон — 20 г; глюкоза (декстроза) — 2 г, NaCl — 5 г, Na2HP04 — 2,5 г, дистиллированная вода — 1000 мл, рН — 7,3. Среду стерилизуют при 121° С в течение 15 минут. До стерилизации в среду добавляют 3,74% тиоционата калия.
Среда с тиоцианатом калия и налидиксовой кислотой. Питательный бульон (Оксоид), содержащий калия тиоцианата 3,75%, налидиксовой кислоты — 100 мкг/мл. Среду стерилизуют при 121° С в течение 15 минут. Налидиксовую кислоту добавляют в виде раствора к стерилизованной среде.
Трипафлавин-налидиксовый агар. Триптозный агар (Дифко) —
41 г; налидиксовая кислота — 0,04 г; дистиллированная вода — 1000 мл. Кристаллическую налидиксовую кислоту (0,8 г) растворяют в 10 мл 1N NaOH и объем доводят до 100 мл дистиллированной водой; 5 мл раствора налидиксовой кислоты добавляют к среде до концентрации 40 мкг/мл. Стерилизуют после этого этапа среду при 120° С в течение 15 минут, охлаждают до 70° С и добавляют раствор трипафлавина до конечной концентрации 10 мкг/мл. Раствор трипафлавина (0,5%-ный, водный) готовят предварительно.
Обогатительный бульон. Питательная основа — триптиказо-соевый бульон с дрожжевым экстрактом, селективными факторами являются солянокислый акрифлавин — 0,02-0,01 г/л, налидиксовая кислота — 0,05 - 0,01 г/л, циклогексимид — 0,05-0,01 г/л.
Оксфорд-агар. К питательной основе добавляют (г/л) эскулин — 1,0, цитрат железистого аммония — 0,5, хлорид лития — 15,0, циклогексимид — 0,4, колистин — 0,02, акрифлавин — 0,005, цефотстан — 0,002, фосфомицин — 0,01.
PALCAM-arap. В питательный агар вносят (г/л) эскулин — 0,8; цитрат железистого аммония — 0,5; хлорид лития — 15,0; акрифлавин — 0,005; полимиксин В — 0,01; цефтазидим — 0,02; фенилрот — 0,08.
Агар Мак-Брайда для листерий. Пептон — 10 г; мясной экстракт —
3 г; NaCl — 5 г; ангидрид глицина — 10 г; LiCl — 0,5 г; фенилэтанол — 2,5 г; агар — 15 г; дистиллированная вода — 1000 мл; рН — 7,3. Среду стерилизуют 15 минут при 121° С. К охлажденной до 45-50° С среде добавляют 5% крови барана.
Индикаторные среды для идентификации листерий. Посевы инкубируют при 37-38° С, результаты учитывают через 3, 6, 24 и 48 часов.
Среда с лакмусом. В 100 мл бульона Хоттингера или МПБ (рН 7,3-7,5) добавляют 1 мл настойки лакмуса, стерилизуют при 110° С 30 минут. Возбудитель листериоза обесцвечивает среду через 3-6 часов. При учете результатов пробирки не встряхивать.
Среда с метиловым красным. В 100 мл бульона Хоттингера или МПБ добавляют 0,3 см стерильного 0,1%-ного водного раствора метилрота. Цвет среды лимонно-желтый. В положительных случаях среда обесцвечивается через 3-6 часов. Восстановление исходного цвета среды не отмечается.
Среда с конгротом. В 100 мл бульона Хоттингера или МПБ вносят 0,3 мл стерильного 0,1%-ного водного раствора конгрота. Цвет среды красный. Возбудитель листериоза обесцвечивает среду через 6-48 часов. Восстановления цвета среды нет.
Среда с амидочерным. В 100 мл бульона Хоттингера или МПБ добавляют 0,3 мл стерильного 0,1%-ного водного раствора амидочерного. Цвет среды черный с фиолетовым оттенком. В положительных случаях обесцвечивание среды отмечается через 6-48 часов. Восстановления цвета среды нет.
Среда с нейтральротом иметиленовым синим. В 100 мл бульона Хоттингера или МПБ вносят по 1 мл 0,1%-ных водных стерильных растворов нейт ральрота и метиленовой сини. Цвет среды зеленый или зеленовато-голубоватый. При учете результатов (через 3-6 часов) пробирки не встряхивать.
 2014-02-17
2014-02-17 1214
1214







