Горением называют процесс экзотермического окисления горючего вещества, который быстро происходит и сопровождается интенсивным выделением тепла. В основе процесса горения лежит химическая реакция между горючим веществом и окислителем, которым служит кислород воздуха.
Горение отличается от процесса окисления: быстротечностью во времени; переменчивостью концентраций компонентов в меру их взаимодействия; изменением формы поверхность реагирования во времени; высокой температурой.
Реакция горения происходит не непосредственно между молекулами исходных веществ (топлива и окислителя), а через промежуточные стадии. Реакция горения является результатом ряда цепных реакций, которые протекают последовательно.
В зависимости от фазового состояния веществ, участвующих в процессе горения (твердые, жидкие, газообразные), химические реакции разделяют на гомогенные, которые происходят между компонентами, находящимися в одной фазе, и гетерогенные, происходящими на границе двух фаз. Примерами гомогенного горения является горение хорошо перемешанных газового топлива и воздуха, а также горение жидких быстро испаряемых топлив. При этом имеется в виду их перемешивание с окислителем в процессе горения. Пример гетерогенного горения - горение твердых топлив и горение капель тяжелых жидких топлив, если фронт горения устанавливается на границе раздела топлива и окислителя. Горение топлива - поточный процесс, и для его течения необходимо введение компонентов (топлива и окислителя) в зону реакции и отвод из нее продуктов сгорания.
|
|
|
В большинстве технических устройств горение обеспечивается розжигом с помощью факела или электрической искры.
Поскольку обеспечить равномерное смешивание воздуха с топливом сложно, воздуха в топку подают больше, чем это необходимо теоретически.
Отношение количества воздуха Vп действительно поданного в топку, к теоретически необходимому V0 называют коэффициентом избытка воздуха:
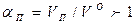 (15.6)
(15.6)
15.6 Состав и объем продуктов сгорания.
При горении топлива стараются обеспечить полное его сгорание, т.е. полное окисление элементов горючей массы. Обычно количество продуктов неполного горения СО, N0, Н2 небольшое, и их наличие незначительно влияет на суммарный объем газов.
Полный объем топочных газов равен сумме сухих газов Vс.г. и водяных паров VH2O:
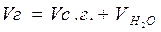 (15.7)
(15.7)
При сгорании 1 кмоль углерода и серы получается по 1 кмоль соответственно СО2 и SO2.
Водяной пар в топочных газах образуется в результате сгорания и выпаривания влаги топлива. Кроме того, влага поступает с воздухом, который обеспечивает горение. При влагосодержании а в = 10г/кг или 13 г/мЗ объем водяного пара в воздухе будет:
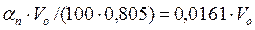 (15.8)
(15.8)
выражениях 0,805 кг/мЗ - плотность водяного пара в нормальных условиях (в идеально-газовом приближении).
Таким образом, теоретический объем водяного пара:
Wh2o= 0,111HP+0,0124WP+0,0161V° (15.9)
 2014-02-09
2014-02-09 664
664







