Рис. 20.4. Роль долихол фосфата в синтезе углеводной части БУК
Таблица 20.2. Моносахариды глико- и мукопротеинов
Таблица 20.1. Представители протеогликанов
Рис. 20.2. Схематическое строение протеогликанов
· N-гликозиламинная связь между N-ацетиллюкозамином и амидным азотом АСН. В образовании этого типа связи, возможно, участвует долихолпроизводные олигосахариды (см. ниже).
| Название | ММ корового белка | Тип ГАГ цепей | Число ГАГ цепей | Локализация | Функция |
| Агрекан | 210 кД | ХДС, КС | хрящ | опорная | |
| Бетагликан | 36 кД | ХДС, ДС | клеточная поверхность, матрикс | связывает TGF-b | |
| Декорин | 40 кД | ХДС, ДС | широко распространен | связывает фибриллы коллагена типа 1 и TGF-b | |
| Перлекан | 600 кД | ГС | 2-15 | базальная мембрана | структурная и фильтрующая функции в базальной мембране |
| Серглицин | 20 кД | ХДС, ДС | 10-15 | секреторные пузырьки лейкоцитов | помогает упаковывать и хранить секретируемые молекулы |
| Синдекан-1 | 32 кД | ХДС, ГС | 1-3 | фибробласт, поверхность эпителия | клеточная адгезия, связывает ФРФ |
Примечание: ХДС - хондроитинсульфат, ГС - гепарансульфат, ДС - дерматан сульфат, ФРФ - фактор роста фибробластов, TGF-b - трансформирующий фактор роста.
|
|
|
Протеогликаны могут образовывать огромные полимерные комплексы с размерами, соизмеримыми с размерами бактерий, а соединяясь с другими белками, они образуют сложные структуры. Примером может служить базальная мембрана. Не все протеогликаны секретируются во внеклеточный матрикс. Находясь на поверхности клеток, они являются частью рецепторных комплексов. Другие ПГ являются интегральной частью плазматических мембран и имеют коровый белок, который пронизывает мембрану или соединен с липидами мембраны.
ПГ могут быть компонентами внутриклеточных секреторных пузырьков, где способствуют упаковке и секреции молекул. Вдобавок они участвуют в регуляции активности секретируемых сигнальных молекул. Обусловлено это тем, что связывание с ПГ может ограничивать пространство действия таких молекул (локализация действия) или стерически блокировать их активность, создавать резервуар сигнальных молекул, пролонгируя их действие, защищать их от расщепления. Изменяя конформацию или концентрируя такие молекулы, ПГ способствуют их более эффективному действию (например, рецепторы на плазматической мембране клетки).
На этих свойствах и механизмах основаны многообразные функции ПГ в организме. Являясь структурными компонентами внеклеточного матрикса, (1) они специфически взаимодействуют с коллагеном, эластином, фибронектином, ламинином, и другими белками. (2) Как полианионы они связывают поликатионы и катионы. (3) ПГ обеспечивают тургор различных тканей, (4) влияют на клеточную миграцию, (5) противостоят компрессионным силам в хрящевой ткани, (6) поддерживают прозрачность роговицы, (7) выполняют структурную роль в склере, (8) действуют как антикоагулянты. (9) Участвуя в формировании рецепторов на поверхности клеток, они обеспечивают взаимодействие между клетками. (10) ПГ регулируют фильтрацию в клубочках почек, (11) входят в состав синаптических и других везикул клеток.
|
|
|
Гликопротеины и мукопротеины - 2 класса белково-углеводных комплексов, которые можно объединить в один
Гликопротеины и мукопротеины -это белково-углеводные комплексы с ковалентно присоединенными углеводными цепями. Различия между ними касаются лишь количества углеводов в комплексе. Если у гликопротеинов углеводы составляют до 10%, то у мукопротеинов - до 50% от массы молекулы. Из состава глико- и мукопротеинов выделено 7 моносахаридов (табл.19.2).
| Тип | Название | Активная форма | Примечание |
| Гексоза | Галактоза | УДФ-Гал | часто расположена субтерминально к N-ацетилнейрминовой кислоте, выделена из корового олигосахарида протеогликанов. |
| Гексоза | Глюкоза | УДФ-Глю | обычно обнаруживается во время синтеза N-связанных гликопротеинов, но отсутствует в зрелых гликопротеинах |
| Гексоза | Манноза | ГДФ-М*ан | сахар N-связанных гликопротеинов |
| N-ацетилнейраминовая кислота | ГМФ-Нейрам | наиболее частый терминальный сахар в гликопротеинах | |
| Дезоксигексоза | Фукоза | ГДФ-Фук | встречается на концевых отделах гликопротеинов |
| Аминогексоза | N-ацетилгалак-тозамин | УДФ-Галамин | выделен из всех гликопротеинов |
| Аминогексоза | N-ацетилглюкозамин | УДФ-Гламин | выделен из всех гликопротеинов |
Функции глико- и мукопротеинов:
1. Являются структурными компонентами мембраны клетки, коллагеновых, эластиновых и фибриновых волокон, костного матрикса
2. Защитные свойства: муцины выполняют роль смазочного материала, обусловливая уменьшение трения соприкасающихся поверхностей
3. Транспортные молекулы для витаминов, липидов, микроэлементов
4. Иммунная защита: иммуноглобулины, антигены гистосовместимости, комплемент, интерферон - вещества гликопротеиновой природы
5. Гормоны - гликопротеины: тиротропин, хорионический гонадотропин
6. Ферменты глико- и мукопротеиновой природы: гидролазы, нуклеазы, гликозидазы, факторы свертывания
7. Выполняют роль соединительного элемента в межклеточном взаимодействии
8. Лектины [3]
Тип связи между белком и углеводом в БУК - результат разных механизмов синтеза
В зависимостиот типа связи между углеводной и белковой частями БУК различают 2 типа БУК: (1) БУК с О-гликозидной связью между СЕР (ТРЕ) и N-ацетилгалактозамином, СЕР и ксилулозой или между гидроксилизином и галактозой (О-связанные БУК); (2) БУК с N- гликозидной связью между АСН и N-ацетилгалактозамином (N-связанные БУК).
Полипептидные цепи (коровые белки) обоих типов БУК синтезируются на мембраносвязанных полирибосомах. Углеводная часть БУК образуется по двум механизмам. (1) Олигосахаридные цепи О-связанных БУК синтезируются путем постепенного добавления моносахаридов к образованной полипептидной цепи. Этот процесс катализируют мембраносвязанные гликозилтрансферазы. Образование одного типа связи требует отдельного специфического фермента (гипотеза одна связь - одна гликозилтрансфераза). Присоединение первого сахара происходит во время трансляции, а остальные добавляются ферментами, локализованными на эндоплазматической сети. Ферменты, присоединяющие последний сахар, локализованы в аппарате Гольджи.
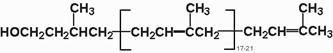
| Рис. 20.3. Структура долихола |
Образование олигосахаридной части N-связанных БУК происходит отдельно от белковой части. Ведущую роль в синтезе олигосахаридов занимает полиизопреновое соединение долихол (состоит 17-20 изопреновых единиц).
|
|
|

Долихолкиназа превращает долихол в долихолфосфат, который, в свою очередь, вступает в реакцию с УДФ-N-ацетил-глюкозамином с образованием долихол-пирофосфат-N-ацетил-глюкозамина. Затем к этому соединению присоединяется еще одна молекула N-ацетил-глюкозамина, 5 молекул маннозы (ГДФ-манноза как субстрат), затем еще 4 маннозы (донор маннозы долихол -манноза) и, наконец, добавляются 3 периферические остатка глюкозы (донор - долихол-глюкоза).
Образованный олигосахарид переносится на АСН белка, расположенного на люминальной поверхности эдоплазматической сети. Катализируется этот процесс мембраносвязанным ферментом - олигосахарид трансферазой. АСН, с которым соединяется олигосахарид, входит в состав трипептида корового белка АСН-Y-СЕР (ТРЕ), где Y любая аминокислота кроме пролина или АСП. Гликозилируются, в основном, секретируемые белки. Белки цитозоля обычно не гликозилируются. Продукт трансферазной реакции, долихолдифосфат, превращается в долихолфосфат при помощи фосфатазы. Долихолфосфат вновь используется в реакциях переноса.
Ряд соединений способны ингибировать различные этапы синтеза гликопротеинов. В экспериментах часто используют туникамицин, дезоксиноджиримицин и сваинсонин, которые оказывают влияние на гликозилирование. Например, если клетки растут в присутствии туникамицина, нарушается процесс гликозилирования. При этом увеличивается чувствительность таких белков к протеолизу, хотя механизмы секреции значительно не нарушаются.
Нарушение распада белково-углеводных комплексов проявляется тяжелыми заболеваниями
Распад белково-углеводных комплексов катализируется с участием большого набора лизосомальных гидролаз, включающих -нейраминидазу, -галактозидазу, -гексозаминидазу, - и -маннозидазы, -фукозидазу, эндо- -N-ацетилглюкозаминидазу и аспартилглюкозаминидазу. Генетически детерминированный дефект указанных ферментов приводит к нарушению распада БУК. Накопление БУК в лизосомах приводит к различным заболеваниям.
|
|
|
Основными признаками болезней, связанными с недостаточностью гликозидаз, являются: (1) аутосомно-рецессивное наследование; (2) различные проявления и нарушения психики; (3) вакуолизация некоторых клеток, видимая под микроскопом; (4) присутствие ненормальных продуктов распада в моче. Диагностика основана на исследовании активности соответствующих ферментов (чаще всего в лейкоцитах). В ряде случаев возможна пренатальная диагностика путем анализа соответствующих ферментов в амниотической жидкости и крови матери.
Из наиболее известных заболеваний этого типа можно выделить маннозидозы, фукозидозы, сиалидозы и аспартилглюкозаминурию. Их причиной является недостаточность соответственно a-маннозидазы, -фукозидазы, нейраминидазы и аспартилглюкозаминидазы. Эти заболевания имеют самые разные проявления, иногда их относят к муколипидозам.
Коллаген - главный белок внеклеточного матрикса
Коллагены - хорошо охарактеризованные фибриллярные белки, найденные у всех многоклеточных живых организмов. Они составляет 25% всех белков организма человека Коллагены секретируются как соединительнотканными клетками, так и различными другими типами клеток. Известно свыше 25 разных коллагеновых a-цепей, каждая из которых кодируется своими генами. Разные комбинации этих генов подвергаются экспрессии в разных тканях. Теоретически такое разнообразие может дать 10000 типов тройных спиралей в составе коллагена. Однако на сегодняшний день выделено всего лишь 15 типов коллагеновых молекул (изоколлагены). Сведения о некоторых из них упоминаются ниже в таблице 19.3.
 2014-02-18
2014-02-18 1686
1686








