Химические методы умягчения воды
Физические методы умягчения воды
Воду нагревают до кипения, в результате чего растворимые гидрокарбонаты кальция и магния превращаются в карбонаты и выпадают в осадок:
100ºC
Ca(HCO3)2 == CaCO3↓ + H2O + CO2
Этим методом удаляется только временная жёсткость воды.
В промышленности применяют следующие способы умягчения воды: известковый, натронный, содовый, фосфатный.
1. Известковый способ. Обрабатывая воду гашёной известью Ca(OH)2, устраняют временную жёсткость воды и связывают оксид углерода (IV):
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2H2O:
Mg(HCO3)2 + Ca(OH)2 = CaCO3↓ + Mg(OH)2 + H2O +CO2
CO2 + Ca(OH)2 = CaCO3↓ + H2O
2. Натронный способ. При действии на воду едким натром достигают устранения временной и постоянной жёсткости:
Mg(HCO3)2 + 4NaOH = Mg(OH)2 + Na2CO3↓ + 2H2O
CaCl2+2NaOH = Ca(OH)2 + 2NaCl
3. Содовый способ. При действии на воду кальцинированной содой Na2CO3 достигают устранения временной и постоянной жёсткости:
Ca(HCO3)2+ Na2CO3 = 2NaHCO3 + CaCO3↓
CaSO4 + Na2CO3 = CaCO3↓ +Na2SO4
4. Фосфатный способ. Обработка воды фосфатом натрия тоже ведёт к связыванию ионов, образующих накипь в виде нерастворимых солей:
3Ca(HCO3)2 + 2Na3PO4 = Ca3(PO4)2↓ +6NaHCO3
3CaSO4 + 2Na3PO4 = Ca3(PO4)2↓ + 3Na2SO4
MgCl2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaCl
Эффективность умягчения воды возрастает от известкового к фосфатному способу при одновременном существенном увеличении стоимости этого процесса.
Поэтому на практике применяют и комбинированные способы, в которых основная часть ионов жёсткости связывается дешёвыми реагентами - известковым молоком и содой, а доумягчение осуществляется фосфатом натрия.
Известково-содовый метод даёт возможность снизить жёсткость до
0,3 мг-экв/л, а фосфатный - до 0,03 мг-экв/л.
Наиболее широкое распространение получил метод ионного обмена благодаря своей эффективности, простоте и экономичности (Рис. 2.4):
Принципиальная схема обессоливания воды методом ионоионообмена (катионирование и анионирование) показана на рисунке 2.4.
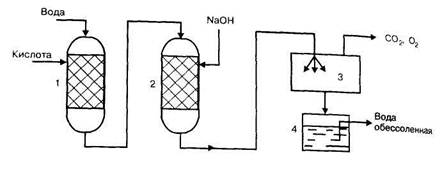
Рис. 2.4. Схема установки для обессоливания воды ионообменным методом. 1 — катионитный фильтр, 2 — анионитный фильтр, 3 —дегазатор, 4 — сборник очищенной воды.
Из воды сначала удаляются ионы кальция, магния и натрия в Н-катионитовом фильтре, в котором на слое крупного кварцевого песка или измельченного керамзита расположен слой катионита. Затем вода последовательно поступает в анионитовый фильтр для удаления анионов. Для регенерации катионита в фильтр периодически подается кислота или раствор хлорида натрия, для регенерации анионита — раствор щелочи. Затем вода подается в дегазатор, где удаляются и воды растворенные диоксид углерода и кислород.
Дегазация осуществляется химическим или физическим способами. Для удаления СО2 воду пропускают через фильтр, заполненный гашеной известью, или добавляют к воде известковое молоко:
СО2 + Са(ОН)2 = СаСО3 + Н2О.
Кислород удаляется фильтрацией воды через слой железных опилок или стружек. Физические способы дегазации состоят в нагревании воды в вакууме или острым паром. В случае необходимости производят обеззараживание воды с целью уничтожения болезнетворных бактерий и окисления органических примесей хлорированием (газообразным хлором, хлорной известью или гидрохлоратом кальция).
!!! Метод основан на способности некоторых нерастворимых синтетических материалов обменивать свои ионы на эквивалентное количество ионов, присутствующих в воде.
Иониты подразделяются на аниониты и катиониты.
Иониты, обменивающие свои катионы на катионы, находящиеся в воде, называют катионитами.
Катиониты обычно содержат подвижные, т. е. способные обмениваться, ионы натрия Na+ (Na+- катиониты) и водорода H+ (H+- катиониты).
Иониты, обменивающие свои анионы на анионы, находящиеся в воде, называются анионитами. Аниониты содержат подвижные гидроксильные группы.
 2014-02-24
2014-02-24 10199
10199








