К основным процессам, происходящим при приготовлении промышленных цинковых сплавов, относятся нагрев и расплавление шихтовых материалов, испарение компонентов сплава, взаимодействие расплава с газами печной атмосферы, материалом тигля или футеровки печей, с флюсами.
При нагреве и расплавлении шихтовых материалов до заданных температур происходит изменение физических, химических и технологических свойств сплавов.
Цинк и сплавы на его основе очень чувствительны к перегреву. Чрезмерный перегрев цинковых расплавов всегда нежелателен, так как вызывает окисление цинка и легирующих элементов, способствует насыщению расплавов водородом и оксидными неметаллическими включениями. Кроме того, ограничения по допустимым температурам перегрева цинковых расплавов обусловливаются низкой температурой кипения цинка и связанным с этим испарением цинка.
Потери металлов от испарения зависят от давления насыщенного пара жидкого металла: чем больше давление паров, тем больше их потери при приготовлении сплавов.
|
|
|
Давление насыщенного пара цинка в зависимости от температуры достаточно точно определяется уравнением
lg Р = - 6650/Т+ 12,0- 1,126 lg Т.
В момент, когда давление паров металла становится равным внешнему давлению, начинается кипение металла, т.е. происходит испарение не только с поверхности, но и по всему объему. Температура кипения металлов не находится в прямой зависимости от температуры плавления (табл. 34).
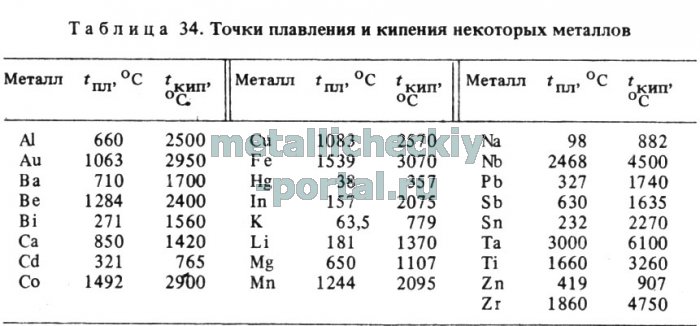
Например, олово имеет температуру плавления 232 °С, т.е. ниже, чем цинк (tПЛ = 419 °С), а температура его кипения (2270 °С) намного выше, чем цинка (907 °С). Это необходимо учитывать при разработке технологии плавки тех или иных цинковых сплавов. Например, при приготовлении цинковых сплавов с медью необходимо принимать специальные меры против излишних потерь цинка, так как температура выплавки сплавов в ряде случаев приближается к температуре кипения цинка.
С уменьшением внешнего давления (т.е. при использовании под вакуумом) скорость испарения увеличивается. Для определения скорости испарения в вакууме обычно пользуются уравнением Лангмюра:

где Рнас - давление насыщенного пара металла при данной температуре Г, Па; Мп - молекулярная масса металла в парообразной фазе; v - скорость испарения, г/ (см2 • с).
По этой формуле можно рассчитать скорости испарения цинка и других элементов при вакуумной плавке металлических расплавов, a также определять, какие более летучие (имеющие большие давления паров) компоненты сплава будут удаляться из расплавов (например, из алюминиевого сплава - цинка и магния; из медных сплавов - цинка). Это явление используется для очистки металла от примесей методом вакуумной дистилляции, например отгоняют цинк из латуни используя различия в точках кипения цинка (907 °С) и меди (2600 °С).
|
|
|
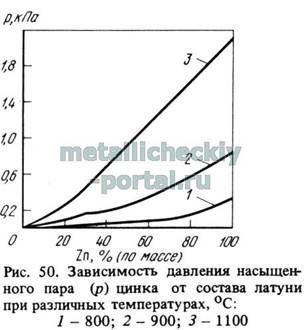
Однако следует учитывать, что давление насыщенного пара цинка над латунью зависит от состава цинковомедных сплавов. На рис. 50, по данным Вольского A.M., приведена зависимость давления пара цинка от состава латуни при разных температурах.
Испарение и кипение металлов в процессе приготовления цинковых сплавов ведут к потерям цинка и компонентов сплава, изменяют химический состав сплавов и ухудшают санитарно-гигиенические условия в литейных цехaх. Из-за значительных потерь цинка некоторые бронзы, содержащие цинк, а также латуни трудно плавить в вакуумных печах, поскольку присадка цинка меняет удельный вес металла, то при расчете веса такого проката лучше всего использовать наш специальный металлокалькулятор онлайн.
Для уменьшения потерь цинка и отдельных легирующих компонентов рабочие сплавы следует выплавлять быстро в печах с минимальной поверхностью расплава, это особенно важно, поскольку цинк довольно дорог, см. цены на мировом рынке - лондонская биржа цветных металлов лме.
Элементы, которые способны образовывать на поверхности расплава прочные оксидные пленки, уменьшают потери цинка при испарении. Например, у латуней с алюминием и кремнием благодаря защитной пленке оксидов этих металлов на поверхности потери цинка при выплавке сплавов значительно меньше, чем у обычных латуней.
 Для уменьшения угара цинка при выплавке цинковых сплавов следует не допускать их перегрева выше допустимых норм. В сухом, воздухе чистый цинк не взаимодействует с газами, но в атмосфере влажного воздуха цинк и его сплавы легко окисляются. Их поверхность покрывается пленкой, состоящей из ZnО3 • 3 Zn(OH)2, которая хорошо предохраняет металл от дальнейшего окисления.
Для уменьшения угара цинка при выплавке цинковых сплавов следует не допускать их перегрева выше допустимых норм. В сухом, воздухе чистый цинк не взаимодействует с газами, но в атмосфере влажного воздуха цинк и его сплавы легко окисляются. Их поверхность покрывается пленкой, состоящей из ZnО3 • 3 Zn(OH)2, которая хорошо предохраняет металл от дальнейшего окисления.
При плавке цинк и цинковые сплавы активно взаимодействуют с газами окружающей среды (кислородом, водородом и др.) и с парами воды, загрязняя расплавы взвешенными неметаллическими и газовыми включениями. Окисление металлической шихты происходит в печи во все периоды плавки (при нагреве, расплавлении, перегреве и разливке). В этот период могут протекать реакции: 2Zn + О2 = = 2ZnO, Zn + Н2О = ZnO + 2Н, Zn + СО2 = ZnO + CO.
Поэтому при выплавке цинковых сплавов необходимо использовать только сухие шихтовые материалы, так как наличие влаги приводит к повышенному окислению цинка и насыщению расплава водородом. Кроме того, для меньшего окисления следует плавку цинка проводить в нейтральной или слабовосстановительной среде. При выплавке цинковых сплавов в первую очередь окисляется при прочих равных условиях тот элемент, который имеет большее сродство к кислороду и большую активность. Степень химического сродства металлов к кислороду можно оценить по значениям упругости диссоциации оксида, изменению энергии Гиббса образования оксида, а также теплотой образования оксида.
Чем меньше упругость диссоциации оксида, тем он прочнее и тем больше сродство данного металла к кислороду. По изменению свободной энергии образования оксида все металлы можно расположить в ряд по их сродству к кислороду. В табл. 35 приведены значения изменения энергии Гиббса (AG) при реакциях окисления некоторых наиболее распространенных элементов.
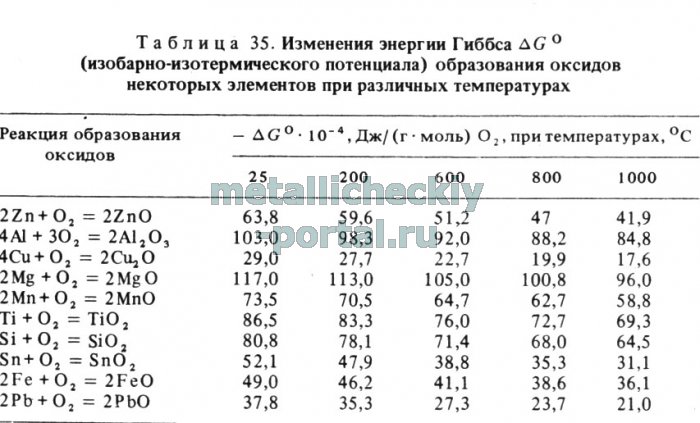
Как видно, более активными к окислению в сравнении с цинком будут магний, алюминий, титан и кремний.
Образующиеся оксиды металлов находятся в цинковых сплавах в виде нерастворимых неметаллических включений (ZnO, MgO, А1203, ТiO2, Si02 и др.), образующих на поверхности расплава слой оксидной пленки. Другими словами, все цинковые сплавы так же, как и нелегированный цинк, взаимодействует с кислородом с образованием нерастворимых ни в жидком, ни в твердом цинке оксидов.
|
|
|
Однако следует учитывать природу оксидов, образовавшихся при окислении цинковых сплавов. В том случае, если поверхность металла покрывается плотной оксидной пленкой, скорость окисления металла при постоянной температуре замедляется по мере увеличения продолжительности выдержки. Окисление в этом случае описывается параболическим уравнением: w2 = кт, где w - количество присоединенного к металлу кислорода, отнесенное к единице поверхности образца, г/см2; т - время выдержки, ч; к - постоянный коэффициент, г-ч/м2. Напротив, если на поверхности металла образуется рыхлая, непрочная оксидная пленка, то процесс окисления подчиняется линейному закону: w = кт.
К окислению жидких металлов, в частности цинка, применимы те же положения, что и к твердым. Так, при плавке цинка на поверхности расплава образуется очень плотная, непроницаемая для кислорода оксидная пленка.
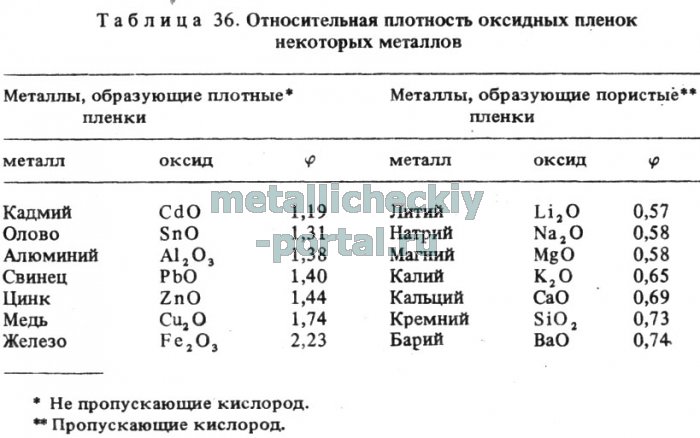
Легирующие элементы изменяют скорость и характер окисления цинковых расплавов в зависимости от значений плотности оксидных пленок. Элементы с φ> 1 понижают скорость окисления и способствуют образованию защитных покрытий на цинке (Al, Pb, Be, Sn, Cd); элементы с φ < 1 повышают скорость окисления цинка благодаря образованию рыхлых поверхностных слоев оксидов (Mg, Са, Si, Li, Na).
Значения коэффициента Пиллинга-Бэдворда для различных элементов, характеризующего плотность оксидной пленки, приведены в табл. 36.
Нерастворимые оксидные включения удаляются из цинковых расплавов путем рафинирования, отстаивания и фильтрации в процессе приготовления рабочих сплавов.
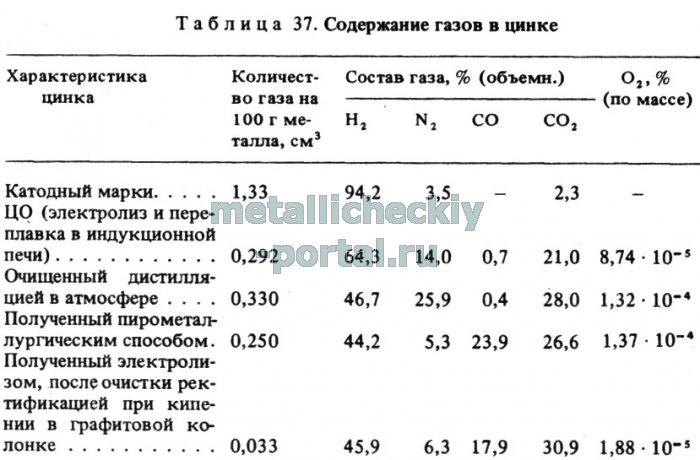
Из других газов, кроме кислорода, в атмосфере плавильных печей присутствуют водород, азот и сложные газы (Н2О, СО2, СпНт и др.). Количество растворенного в металлах водорода составляет 70-98 % от общего количества растворенных газов. Анализ содержания растворимых газов в цинковых образцах, полученных различными способами, по данным Орловцева Ю.В., показал (табл. 37), что цинк марки ЦО, полученный при переплавке катодов, содержит больше водорода, чем цинк, полученный пирометаллургическим способом и после ректификации. Наиболее эффективным способом дегазации является вакуумная обработка расплавленного цинка.
|
|
|
Цинк, содержащий водород, имеет повышенную хрупкость и пониженную пластичность. Основные легирующие элементы в цинковых сплавах образуют с водородом эндотермические твердые растворы внедрения. Растворимость водорода при атмосферном давлении в этих металлах увеличивается с повышением температуры как в твердом, так и в жидком состоянии, как это видно из данных, приведенных ниже:
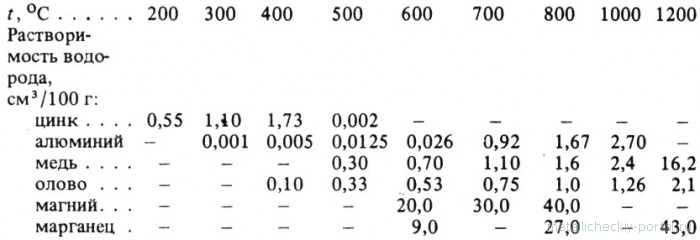
Относительно характера взаимодействия водорода с цинком и данных о растворимости водорода в цинке сведения противоречивы. По данным работы, растворимость водорода в цинке растет с повышением температуры и составляет соответственно 0,6; 0,7; 0,8 см3 на 100 г металла при температурах 973, 1013 и 1073 К. Напротив, отмечается, что водород не растворяется в цинке и может считаться практически инертным газом по отношению к цинку. Растворимость водорода в расплавленном цинке уменьшается с повышением температуры. При этом растворимость водорода в твердом цинке составляет соответственно 0,85; 1,16; 1,73 см3 на 100 г металла при температурах 479, 583 и 673 К и давлении 101,3 МПа. Растворимость водорода в расплавленном цинке при 789 К составляет 1,8 • 10-3 см3 на 100 г металла.
Скачок изменения растворимости водорода при переходе цинка из жидкого состояния (Сж) в твердое (Схв) составляет Сж/Ств = = 0,12, что исключает, по мнению авторов, возможность образования газовой пористости в цинковых отливках. В отличие от цинка в других элементах Сж/Ств>1(А1 19,2; Си 3,0; Mg 1,3; Ti 1,73), вследствие чего для этих металлов существует опасность возникновения пористости в отливках.
По-видимому, нет основания опасаться насыщения цинка водородом в процессе приготовления, а склонность цинковых сплавов к образованию газовой пористости можно объяснить влиянием легирующих элементов на изменение растворимости водорода в цинковых расплавах.
Влияние легирующих элементов на растворимость водорода в цинке не указывает на какую-либо общую закономерность. Например, растворимость водорода в цинковом расплаве уменьшается с увеличением содержания алюминия до 10%. Так, если для 973 К растворимость водорода в цинке составляет 0,6 см3 на 100 г металла, то в сплаве цинк - 10% А1- около 0,4 см3/100 г. Напротив, в другой работе указывается, что растворимость водорода в цинке повышается с увеличением содержания алюминия. Добавка меди до 4 % практически не оказывает влияния на растворимость водорода.
Можно ожидать, что легирование цинка гидридобразующими элементами (титан, цирконий, церий и др.) будет приводить к возрастанию растворимости водорода в цинковых сплавах. Растворимый в цинковых расплавах водород в количествах, превышающих его концентрацию в твердом сплаве на основе цинка, способствует образованию газовой пористости в отливках, поэтому в процессе приготовления рабочих сплавов следует дегазировать расплавы.
С азотом в реальных условиях плавки цинк практически не взаимодействует, поэтому при плавке цинка можно применять азот не только в качестве защитной атмосферы, но и для очистки цинковых расплавов от водорода.
Сложные молекулярные газы, присутствующие в атмосфере плавильных печей (С02, Н2 О, СпHm, S02 и др.), в цинковых расплавах не растворяются, но весьма активно взаимодействуют с расплавленным цинком с образованием оксидов и других соединений: С02 + + Zn=ZnO + CO, H20 + Zn=Zn0 + 2H, S02 + 3Zn=2Zn0 + ZnS. Пpи нагревании цинка в токе ацетилена образуется карбид цинка: С2Н2 +Zn=ZnC2 + 2Н.
Опасно взаимодействие расплавляемого цинка с водородсодержащими газами, а особенно с водой. При взаимодействии влаги с цинковым расплавом образуются нерастворимые оксиды и выделяется атомарный водород, загрязняющие цинковые расплавы. Восстановительная атмосфера печи также облегчает процесс диссоциации воды: Н20 + С0=С02 + 2Н, Н20 + С=С0 + 2Н. Значительная часть выделяющегося при этом водорода поглощается расплавом. По этой причине при плавке цинка и сплавов на его основе необходимо создавать в печи нейтральную или слабоокисленную среду.
Таким образом, основными источниками загрязнения цинковых расплавов газами и оксидными включениями являются влага печной атмосферы, а также влага, вносимая в печь с окисленной и загрязненной шихтой, из футеровки, плавильно-разливочного инструмента и т.п.
При плавке цинка в печах с огнеупорной набивкой или футеровкой практически исключена опасность взаимодействия расплавленного цинка с оксидами футеровки. Это обусловливается тем, что обменные реакции между расплавленным цинком и материалом футеровки невозможны, поскольку прочность оксидов, входящих в состав футеровки (Si02, А1203, MgO, СаО, Сr203 и др.), выше химической устойчивости оксида цинка.
Согласно термодинамическим расчетам не исключается вероятность химического взаимодействия легирующих цинк элементов (магний, алюминий, титан, кремний и др.) и оксидов на их основе с оксидами футеровки. Однако вследствие достаточно малых концентраций в цинковых сплавах легирующих элементов (магния, титана, кремния) и невысоких температур плавки цинковые сплавы также можно готовить в печах в контакте практически с любым огнеупорным материалом.
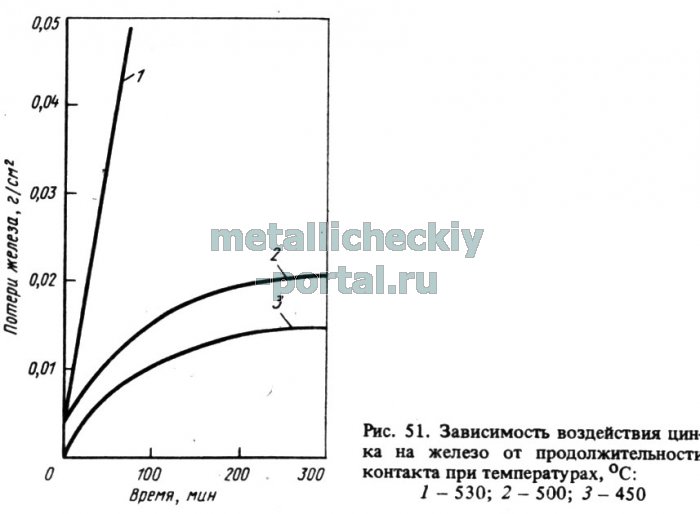
В процессах плавки цинка и сплавов на его основе в плавильных тигельных печах между расплавленным металлом или его оксидами и стенками плавильного тигля может происходить физико-химическое взаимодействие, проявляющееся в растворении материала тигля. Для плавки цинковых сплавов используют чугунные и стальные тигли. Однако в случаях перегрева цинковых расплавов выше 480-500 С наблюдается растворение (разъедание) материала тигля, вследствие чего снижается срок его службы. Потери железа при взаимодействии цинкового расплава с поверхностью тигля увеличиваются не только с повышением температуры, но и с увеличением продолжительности контакта (рис. 51).
Присутствие железа в цинковых сплавах вызывает образование новых фаз: Fe5Zn21, Fe3Zn10, FeZn7, FeZn10, FeZnl5, которые ухудшают литейные свойства, коррозионную стойкость и механические свойства металла. Отрицательное влияние повышенных концентраций железа в цинке сказывается, в частности, на вязкости (понижении жидкотекучести) расплавов. Так, повышение содержания железа с 0,05 до 0,20 % снижает жидкотекучесть цинкового расплава на 20%. Имеются сведения об ухудшении условий нанесения цинковых покрытий горячим цинкованием при повышенных содержаниях железа в цинке.
В целях улучшения качества цинка и цинковых сплавов при их приготовлении применяют различные хлористые соли (флюсы). Так, для удаления из цинковых расплавов взвешенных неметаллических включений и газов при переплавке катодного цинка широкое распространение получили хлористый аммоний (NH4C1) и хлористый цинк (ZnCl2). При выборе состава флюсов должны учитываться следующие требования: 1) температура плавления флюса должна быть ниже температуры плавления сплава; 2) плотность флюса должна отличаться oт плотности цинкового расплава; 3) флюсы не должны взаимодействовать с материалом футеровки печи или тигля.
Рафинирующее действие флюсов может состоять в адсорбции и растворении взвешенных в расплаве включений или в химическом взаимодействии флюса с примесями, причем продукты взаимодействия образуются на поверхности расплава в виде легко удаляемого шлака.
Основные особенности процессов, происходящих при плавке цинковых сплавов, необходимо учитывать при разработке технологических процессов выплавки качественных сплавов на основе цинка.
 2014-02-09
2014-02-09 3521
3521







