Образования комплексов с переносом заряда (КПЗ), эксимеров и эксиплексов приводят к существенным изменениям спектроскопических характеристик молекулярных систем и поэтому могут быть использованы в молекулярной оптической сенсорике. Здесь мы рассмотрим эти эффекты для молекул ароматических углеводородов и их некоторых метильных замещенных. Кратко изложены основные теоретические представления о природе комплексов с переносом заряда эксиплексов и эксимеров.
Прежде чем переходить к изложению, необходимо сделать некоторые терминологические пояснения. Классическое понятие комплексов с переносом заряда подразумевает образование комплексов уже в основном электронном состоянии. Электронное возбуждение приводит лишь к увеличению доли переноса заряда между донором и акцептором электрона и, как следствие, увеличение энергии связи в возбужденном состоянии по сравнению с основным. В соответствии с этим при образовании КПЗ появляется новая полоса поглощения и люминесценции. Первоначальное понятие эксиплекса предполагает, что комплекс устойчив только в возбужденном состоянии и в соответствии с этим его образование приводит к появлению только новой полосы люминесценции,но не поглощения. На самом деле КПЗ и эксиплекс имеют одинаковую электронно-донорно-акцепторную природу и отличаются лишь различным весом конфигурации с переносом заряда в основном состоянии и, следовательно, различным соотношением равновесных расстояний в основном и возбужденном состояниях. Поскольку КПЗ и эксимер имеют дипольный момент их взаимный переход возможен в основном электронном состоянии при изменениии полярности растворителя. Детально эти вопросы не рассмотрены.
|
|
|
Начнем с классических представлений о природе КПЗ.
Теория комплексов с переносом заряда (распространенным также является термин электронный донорно-акцепторный комплекс) и их спектроскопических свойств была разработана Малликеном. Ее содержание заключается в следующем. Волновая функция системы донора электрона Д и взаимодействующего с ним акцептора А строится в виде суперпозиции двух конфигураций, одна из которых φ0 соответствует основному состоянию молекул D и А, в которой взаимодействие молекул включает в общем случае кулоновские члены и члены обменного отталкивания. Вторая конфигурация φ1 соответствует состоянию системы с переходом электрона с донора электрона на акцептор D+А-. Эти конфигурации связаны взаимодействием  , где Н - электронный гамильтониан системы R – расстояние между Д и А. При R стремящемся к бесконечности энергия конфигурации φ1 относительно энергии конфигурации φ0 равна
, где Н - электронный гамильтониан системы R – расстояние между Д и А. При R стремящемся к бесконечности энергия конфигурации φ1 относительно энергии конфигурации φ0 равна 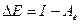 , где I – потенциал ионизации молекулы донора электрона, а Ае - энергия электронного сродства молекулы акцептора. При конечных значениях R величина ΔЕ должна быть уменьшена навеличину энергии кулоновского взаимодействия Д+ и А- Q(R):
, где I – потенциал ионизации молекулы донора электрона, а Ае - энергия электронного сродства молекулы акцептора. При конечных значениях R величина ΔЕ должна быть уменьшена навеличину энергии кулоновского взаимодействия Д+ и А- Q(R): 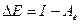 - Q(R). При этом естественно считается, что эта
- Q(R). При этом естественно считается, что эта  величина больше нуля, поскольку в противном случае основному состоянию системы отвечала бы ионная пара Д+А-. При построении волновой функции системы в виде линейной комбинации φ0 и φ1 дает следующие выражения для энeргии основного и возбужденного состояний системы при W01(R)<<ΔЕ(R)
величина больше нуля, поскольку в противном случае основному состоянию системы отвечала бы ионная пара Д+А-. При построении волновой функции системы в виде линейной комбинации φ0 и φ1 дает следующие выражения для энeргии основного и возбужденного состояний системы при W01(R)<<ΔЕ(R) :
:
|
|
|
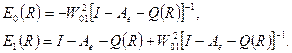 (1)
(1)
Из этих выражений видно, что учет взаимодействия конфигураций приводит к стабилизации основного состояния,что соответствует образованию комплекса, и некоторой дестабилизации возбужденного состояния, в котором связь осуществляется за счет кулоновского притяжения Д+ и А-. Представление волновой функции в виде суммы только двух конфигураций основано на предположении, что локальные возбужденные состояния А и Д расположены гораздо выше чем состояние φ1.
Главный результат теоретического рассмотрения Малликена заключается в установлении связи энергии перехода с переносом заряда и потенциалом ионизации донора электрона и величиной энергии электронного сродства молекулы акцептора электрона. Как следует из (1) энергия перехода равна
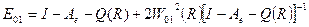
 . (2)
. (2)
Отсюда видно что полоса переноса заряда смещается в длинноволновую область с уменьшением потенциала ионизации донора электрона и
увеличением энергии электронного сродства акцептора. Огромное количество экспериментальных данных подтверждают этот вывод. Подчеркнем,что, поскольку при возбуждении системы происходит существенное увеличение дипольного момента системы, положение полосы переноса заряда сильно зависит от полярности растворителя. С ростом полярности растворителя происходит сдвиг полосы в красную сторону в соот ветствие с общими положения ми сольватохромии[ 2].Выражение (2) имеет силу для неполярных растворителей и для газовой фазы.
Положение максимума полосы ПЗ (λ) и значение коэффициента
экстинции (ε) комплексов некоторых углеводородов с хлоранилом. В последнем столбце указан потенциал ионизации углеводорода (I).
| № п/п | Донор | λ (нм) | ε(л моль-1см-1) | I(эВ) |
| Гексаметилбензол | 5171 | 7,85 | ||
| Диметиланилин | 6491 | 7,14 | ||
| Дурол | 4961 | 8,025 | ||
| Нафталин | 4781 | 8,12 | ||
| Трифенилен | 4831 | 8,09 | ||
| Фенантрен | 4631 | 7,75 | ||
| 1,2-Бензантрен | 5921 | 7,5 | ||
| Антрацен | 6251 | 7,38 | ||
| Пирен | 6011 | 7,55 | ||
| Стильбен | 5151 | 7,7 | ||
| Дифенил | 4411 | 8,23 | ||
| Тетрацен | 7651 | - | 6,88 | |
| Перилен | 7221 | - | 6,8 | |
| Коронен | 5931 | - | 7,44 | |
| 1,2,5,6-Дибензантрацен | 5821 | 7,8 | ||
| Хризен | 5411 | - | 7,8 | |
| Бензол | 3471 | 9,25 | ||
| п-Ксилол | 4311 | - | 8,44 | |
| м-Ксилол | 3912 | - | 8,56 | |
| Толуол | 3652 | - | 8,97 | |
| Мезителен | 4082 | - | 8,4 | |
| Дурол | 4522 | - | 8,025 | |
| Пентаметилбензол | 4762 | - | 7,92 | |
| 24 Гексаметилбензол 5052 - 7,85 |
1 –растворы в четыреххлористом углероде, 2- растворы в циклогексане.
Совокупность экспериментальных данных по спектрам поглощения и
люминесценции вполне удовлетворительно описывается в рамках простой модели Малликена. По иному обстоит дело с вероятностями оптических переходов. Для их описания нельзя ограничится учетом только двух конфигураций в разложении волновой функции φ0 и φ1, как это описано выше, а необходим учет конфигураций локальных возбужденных состояний молекул донора и акцептора. Детальный анализ этого вопроса представлен в работе.
Волновая функция системы в общем случае строится в виде:
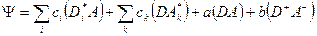 , (5)
, (5)
где  - волновая функция системы, когда молекула донора находится в возбужденном состоянии i,
- волновая функция системы, когда молекула донора находится в возбужденном состоянии i,  -тоже,когда молекула акцептора возбуждена в состояние k,
-тоже,когда молекула акцептора возбуждена в состояние k,  - волновая функция основного состояния молекул,
- волновая функция основного состояния молекул, 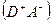 - волновая функция состояния с переносом заряда,
- волновая функция состояния с переносом заряда,  ,
, ,
, и b коэффициенты разложения.
и b коэффициенты разложения.
|
|
|
Таблица 4.Средняя частота флуоресценции (ν) измеренная (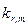 ) и вычисленная (
) и вычисленная (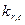 ) константа скорости радиационного распада возбужденного состояния и процент вклада конфигурации с переносом заряда в волновую функцию возбужденного состояния комплексов метилзамещенных бензола с 2,6,9,10- тетрацианантраценом.
) константа скорости радиационного распада возбужденного состояния и процент вклада конфигурации с переносом заряда в волновую функцию возбужденного состояния комплексов метилзамещенных бензола с 2,6,9,10- тетрацианантраценом.
| Донор | Растворитель | ν(103см-1) | 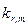 (106 с-1) (106 с-1)
| 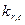 (106 с-1) (106 с-1)
| % ПЗ |
| Пара-ксилол | циклогексан | 19,69 | 6,96 | 6,47 | |
| Тетраметил бензол | циклогексан | 18,89 | 3,67 | 3,65 | |
| Дурол | циклогексан | 17,82 | 1,89 | 1,99 | |
| Пентаметилбензол | циклогексан | 17,41 | 1,70 | 1,65 | |
| Гексаметилбензол | циклогексан | 16,36 | 1,22 | 1,18 | |
| Пара-ксилол | CCl4 | 18,98 | 4,72 | 3,87 | |
| Тетраметил бензол | CCl4 | 18,09 | 2,61 | 2,29 | |
| Дурол | CCl4 | 16,89 | 1,59 | 1,33 | |
| Пентаметилбензол | CCl4 | 16,45 | 1,26 | 1,13 | |
| Гексаметилбензол | CCl4 | 15,63 | 0,98 | 0,88 | |
| Пара-ксилол | трихлорэтилен | 18,41 | 2,77 | 2,72 | |
| Тетраметил | трихлорэтилен | 17,53 | 1,85 | 1,74 | |
| Дурол | трихлорэтилен | 16,27 | 1,13 | 1,07 | |
| Гексаметилбензол | трихлорэтилен | 14,75 | 0,75 | 0,70 | |
| Дурол | диоксан | 14,91 | 0,76 | 0,73 | |
| Гексаметилбензол | диоксан | 13,74 | 0,54 | 0,57 | |
| Пентаметилбензол | толуол | 14,98 | 0,78 | 0,74 | |
| Гексаметилбензол | толуол | 14,15 | 0,69 | 0,62 | |
| Пара-ксилол | фторбензол | 17,20 | 1,38 | 1,51 | |
| Тетраметил бензол | фторбензол | 16,21 | 1,00 | 1,05 | |
| Дурол | фторбензол | 14,91 | 0,79 | 0,73 | |
| Пентаметилбензол | фторбензол | 14,45 | 0,64 | 0,66 | |
| Гексаметилбензол | фторбензол | 13,52 | 0,60 | 0,55 | |
| Пара-ксилол | дихлорметан | 16,68 | 1,10 | 1,23 | |
| Дурол | дихлорметан | 14,45 | 0,68 | 0,66 | |
| Пентаметилбензол | дихлорметан | 13,93 | 0,59 | 0,59 | |
| Гексаметилбензол | дихлорметан | 13,11 | 0,44 | 0,51 |
Таблица 5. Средняя частота флуоресценции (ν) измеренная (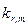 ) и вычисленная (
) и вычисленная (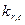 ) константа скорости радиационного распада возбужденного состояния и процент вклада конфигурации с переносом заряда в волновую функцию возбужденного состояния комплексов метилзамещенных бензола с 9,10-дицианантраценом.
) константа скорости радиационного распада возбужденного состояния и процент вклада конфигурации с переносом заряда в волновую функцию возбужденного состояния комплексов метилзамещенных бензола с 9,10-дицианантраценом.
|
|
|
| Донор | Растворитель | ν (103см-1) | 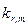 (106с-1) (106с-1)
| 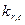 (106с-1) (106с-1)
| %ПЗ |
| Дурол | циклогексан | 20,33 | 8,69 | 9,94 | |
| Пентаметилбензол | циклогексан | 19,80 | 6,27 | 6,49 | |
| Гексаметилбензол | циклогексан | 18,97 | 3,64 | 3,71 | |
| Дурол | трихлорэтилен | 19,42 | 6,15 | 4,94 | |
| Пентаметилбензол | трихлорэтилен | 18,82 | 3,99 | 3,40 | |
| Гексаметилбензол | трихлорэтилен | 18,02 | 2,22 | 2,27 | |
| Пентаметилбензол | диоксан | 18,25 | 2,69 | 2,52 | |
| Гексаметилбензол | диоксан | 17,33 | 1,73 | 1,73 | |
| Пентаметилбензол | пара-ксилол | 18,67 | 3,48 | 3,13 | |
| Гексаметилбензол | пара-ксилол | 17,89 | 2,04 | 2,14 | |
| Дурол | фторбензол | 18,71 | 3,65 | 3,20 | |
| Пентаметилбензол | фторбензол | 18,04 | 2,42 | 2,32 | |
| Гексаметилбензол | фторбензол | 17,08 | 1,62 | 1,57 | |
| Пентаметилбензол | дихлорметан | 17,32 | 1,90 | 1,71 | |
| Гексаметилбензол | дихлорметан | 16,35 | 1,29 | 1,26 | |
| Пентаметилбензол | о-дихлорбензол | 17,82 | 2,01 | 2,08 | |
| Гексаметилбензол | о-дихлорбензол | 16,90 | 1,41 | 1,48 | |
| Дурол | бутиронитрил | 16,76 | 1,58 | 1,42 | |
| Пентаметилбензол | бутиронитрил | 16,20 | 1,29 | 1,21 | |
| Гексаметилбензол | бутиронитрил | 15,40 | 0,88 | 1,00 | |
| Дурол | ацетонитрил | 16,12 | 1,30 | 1,18 | |
| Пентаметилбензол | ацетонитрил | 15,52 | 1,07 | 1,02 |
Образование комплексов с переносом заряда и эксиплексов приводит не только к возникновению нового излучения, но и к тушению лминесценции молекул образующих комплекс. Новая люминесценция, тушение люминесценции
 2014-02-09
2014-02-09 3010
3010







