Рис. 6 12014
Рис. 5 12012
Рисунок 12008
Рис.1 Фундаментальные частицы
Теория великого объединения. Согласно современным представлениям, при очень высоких температурах (и, соответственно, энергиях) все четыре взаимодействия объединяются в одно. Так, при энергии 100 ГэВ объединяются электромагнитное и слабое взаимодействия. Такая энергия соответствует температуре Вселенной через 10-10 с после Большого Взрыва. Это открытие, сделанное в ЦЕРНе, позволяет предположить, что при энергии порядка 1015 ГэВ произойдет объединение электромагнитного, слабого и сильного взаимодействий, а при 1019 ГэВ к ним присоединится и гравитационное. Эти теории называются Теориями Великого Объединения (ТВО).
Проблема элементарных частиц связана с самыми основами естественно-научной картины мира, и изучается она в некотором отрыве от других областей физики. Здесь особенно интересно то, что ответы на многие вопросы, связанные с элементарными частицами ищутся в современной космологии, в моделях первичного нуклеосинтеза, т.е. ядерного синтеза в первые мгновения после Большого Взрыва – гипотетического Начала Вселенной. Именно в этот период, как считается были порождены элементарные частицы. Дело еще и в том, что ускорителей, на которых можно было бы получить энергии, соответствующие энергиям объединения трех и четырех взаимодействий пока не предвидится, поэтому и обращаются к Вселенной, чтобы найти в ней возможные ограничения для огромного числа элементарных частиц. Таким образом, в последние 30 лет между физикой элементарных частиц и космологией существует тесная связь. Совокупность астрофизических данных можно рассматривать как «экспериментальный материал», накопленный в результате работы Вселенной как гигантского ускорителя частиц.
|
|
|
3. Атомное ядро
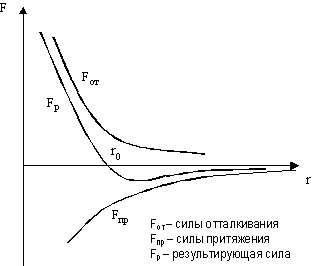
Рис. 2
Под ядром атома понимается его центральная часть, в которой сосредоточена практически вся масса атома и весь его положительный заряд. Ядро состоит из нуклонов – протонов и нейтронов (обозначение p и n).
Масса протона mP = 1,673×10-27 =1,836me,
mn = 1,675×10-27 = 1835,5me.
Масса ядра не равна сумме масс протонов и нейтронов, входящих в него (т.н. «дефект масс»). Протон несет элементарный положительный заряд, нейтрон – частица незаряженная. Число электронов в атоме равно порядковому номеру Z элемента в таблице Менделеева, а число протонов, поскольку в целом атом нейтрален, равно числу электронов. Тогда число нейтронов в ядре определяется следующим образом: NP = A – Z, где А – массовое число, т.е. целое число, ближайшее к атомной массе элемента в таблице Менделеева, Z – зарядовое число (число протонов). Для обозначения ядер применяется запись ZXA, где Х – символ химического элемента в таблице Менделеева. Ядра с одинаковыми Z, но разными А называются изотопами. Сейчас известно более 300 устойчивых и более 1000 неустойчивых изотопов. С неустойчивыми изотопами связано явление радиоактивности – ядерного распада.
|
|
|
Ядро в целом – устойчивая система, для его разрушения необходимо затратить энергию. Эта энергия называется энергией связи ядра. Энергия связи, приходящаяся на один нуклон, называется удельной энергией связи. Нуклоны в ядре удерживаются ядерными силами, представляющими сильное взаимодействие и имеют обменный характер. Ядерные силы обладают рядом свойств:
1. Ядерные силы являются короткодействующими (радиус действия порядка 10-15 м) На этих расстояниях они значительно превышают кулоновские силы отталкивания протонов. При значительном уменьшении расстояния притяжение нуклонов сменяется отталкиванием (см. рис.2).
2. Ядерные силы обладают зарядовой независимостью, т.е. действуют как между заряженными, так и между нейтральными частицами.
3. Ядерные силы обладают свойствами насыщения. Это означает, что каждый нуклон в ядре взаимодействует лишь с ограниченным числом ближайших к нему нуклонов.
4. Ядерные силы не являются центральными. Их величина зависит от ориентации спинов частиц.
4. Молекулы и реакционная способность веществ.
Молекула – наименьшая структурная единица химического соединения, обладающая его главными химическими свойствами. Молекулы простых веществ состоят из одинаковых атомов, сложных – из разных атомов. Инертные газы (гелий, неон, аргон, криптон, ксенон, радон) находятся в одноатомной состоянии. Существует большое количество соединений, молекулы которых состоят из многих тысяч атомов (искусственные полимеры, белки, целлюлоза). Такие молекулы называются макромолекулами.
Как известно, химия изучает процессы превращения молекул при взаимодействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного поля), во время которых образуются новые химические связи. Под химической связью понимается результат взаимодействия между атомами, выражающийся в создании определенной конфигурации атомов, отличающих один тип молекулы от другого.
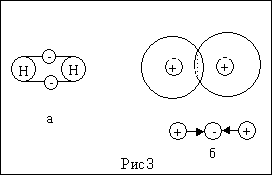
В молекуле выделяют два основных типа связей: ионную и ковалентную (см. рис. 3а и 3б), а также водородную.
При ионной связи один атом отдает другому один или несколько электронов, и так каждый атом становится обладателем стабильного числа электронов. (Например, у атома хлора для стабильности недостает одного электрона, а у атома натрия во внешней оболочке - только один электрон. Его принимает атом хлора, и тогда у натрия протонов становится больше, чем электронов. Атомы натрия и хлора, превратившись в положительно и отрицательно заряженные ионы, притягиваются друг к другу и образуют поваренную соль).
При ковалентной связи двух атомов возникает обобществленная пара электронов, по одному от каждого атома (пример – молекула водорода). Оба атома притягивают эту пару электронов с одинаковой силой, и электроны (или электронное облако) находятся большее время между ними. Если ковалентная связь образуется между атомами разных элементов, то электронное облако оказывается смещенным, т.е. большее время находится ближе к более притягивающему атому. Такую связь называют полярной, или электрически несимметричной (в последнем случае одна приближается к ионной).
Водородная связь названа так из-за атома водорода, который соединен ковалентной связью с другим атомом (например, кислорода или азота) так, что положительной оказывается водородная часть молекулы. Этот частично положительный водородный «край» притягивается третьим, отрицательно заряженным атомом (опять же кислорода или азота). Эта связь слабее, чем две предыдущие, но широко распространена в живой материи. Практически, можно сказать, что на ней держится мир живого.
|
|
|
Силы взаимодействия между атомами являются короткодействующими
(радиус действия r ~10-9 м, размер атома ~ 10-10м). Причем одновременно действуют как силы притяжения, так и силы отталкивания, но они по-разному зависят от расстояния. Схема здесь та же, что и на рис. 2. При r = r0 – состояние устойчивого равновесия, на этом расстоянии и находятся атомы, образующие молекулу. Если увеличить r - увеличиваются силы притяжения и возвращают систему в исходное состояние. При r < r0 силы отталкивания также возвращают систему в состояние устойчивого равновесия.
Энергия химических связей. Химические связи можно рассматривать с точки зрения превращения энергии: если при создании молекулы
ее энергия меньше, чем сумма энергий составляющих ее атомов, то она может существовать, т.е. ее связь устойчива. Устойчивым считается состояние, в котором потенциальная энергия минимальна, поэтому при образовании молекулы атомы находятся в потенциальной яме, совершая небольшие тепловые колебания около положения равновесия (см. рис.4). Расстояние от вертикальной оси до дна ямы соответствует равновесию – на этом расстоянии находились бы молекулы, если бы прекратилось тепловое движение. Точки левее дна соответствуют отталкиванию, правые – притяжению. Крутизна кривой выражает силу взаимодействия между атомами: чем круче кривая, тем больше сила взаимодействия.
Для разных пар атомов различны не только расстояния от вертикальной оси до дна ямы, но и глубина ям. Действительно, для того, чтобы выбраться из ямы, нужна энергия, соответствующая глубине ямы. Поэтому глубину ямы можно назвать энергией связи частиц, или энергией ассоциации. Энергия, необходимая для разложения молекулы на атомы, называется энергией диссоциации. Она равна энергии ассоциации.
|
|
|
Насыщаемость молекул, т.е. способность присоединять атомы, определяет их постоянный состав для данного вещества и связана с валентностью – свойством атомов (или группы атомов) соединяться с некоторым числом других атомов. Величина валентности определяется числом атомов водорода (или другого одновалентного элемента), с которыми соединяется атом данного элемента.
Химические реакции и их направленность. Химические реакции – это основа химии. Одни реакции идут в обе стороны (тогда и стрелки в уравнении реакции рисуют в обе стороны), т.е. являются обратимыми, другие только в одну, третьи – вообще не идут). Здесь важно представлять, от чего зависит возможность осуществления реакции, т.е. перестройки химических связей. Ответ на этот вопрос дает термодинамика. Рассмотрим условия самопроизвольного развития химической реакции и условия ее возникновения. Допустим, вы прижгли ранку перекисью водорода (неустойчивое соединение): 2Н2О2 ® 2Н2О + О2, но обратной реакции не будет. Термодинамика объясняет это так: реакция пойдет только при уменьшении энергии веществ и увеличении энтропии. В самом деле, энтропия растет, так как в малой молекуле воды (она меньше, чем молекула перекиси водорода) расположение атомов менее упорядочено, чем в большой. Реакция возможна, если она сопровождается уменьшением величины свободной энергии F = E – TS. (Пример с камнем: когда он падает в поле сил тяготения, его потенциальная энергия уменьшается – обратно он самопроизвольно не поднимется). В химических реакциях обязателен и учет изменения энтропии, так как возможность реакции еще не означает, что она самопроизвольно пойдет.
Развитие квантовой химии позволило рассмотреть на микроуровне протекание реакций, отдельные молекулы и их электронные структуры. Использование термодинамического подхода, описывающего не отдельные объекты, а систему в целом, позволяет глубже понять тенденции протекания реакций.
Свободные радикалы. В прошлом столетии только два типа частиц считали участвующими в химических реакциях: атомы и молекулы. В 1900 г. Мозес Гомберг (Украина) обнаружил третью – свободный радикал. Он выделил некоторое соединение, способное вступать в реакции, и доказал, что оно представляет из себя половину молекулы (обозначается точкой над символом, например, 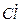 ).
).
Подводя некоторый итог, можно сказать, что при химических превращениях на первый план выступают реакционная способность, энергетические и энтропийные возможности, каталитические и кинетические закономерности.
Химическое равновесие и принцип Ле-Шателье. В общем случае, в химической системе имеют место как прямые, так и обратные реакции, причем большинство химических реакций не идут до конца. Здесь становится важным понятие равновесия между прямой и обратной реакциями. В какой-то момент их скорости сравняются, и в данной системе при данных условиях установится динамическое равновесие. Вывести систему из равновесия можно, только изменив условия согласно принципу, предложенному в 1884 г. Анри Луи Ле Шателье (1850-1936): «если в системе, находящейся в равновесии, изменить один из факторов равновесия. Например, увеличить давление, то произойдет реакция, сопровождающаяся уменьшением объема, и наоборот. Если же такие реакции происходят без изменения объема, то изменение давления не будет влиять на равновесие». Другая, современная формулировка этого принципа следующая:
Внешнее воздействие, которое выводит систему из термодинамического равновесия, вызывает в ней процессы, направленные на ослабление результатов такого воздействия.
Ле Шателье применял этот закон в промышленных условиях для оптимизации синтеза аммиака, производства стекла и цемента, выплавки металлов, получения взрывчатых веществ. Как оказалось, катализаторы не влияют на положение равновесия: они одинаково влияют на прямую и обратную реакции, ускоряют достижение равновесия, но не сдвигают его.
В настоящее время принцип Ле Шателье рассматривается как общий принцип стабильности, согласующий взаимосвязи между элементами Вселенной (Универсума), в своей расширенной трактовке он может быть распространен на живые системы, на социальные системы. Так, с появлением жизни возникает принцип отбора, основанный на стремлении живого сохранить свой гомеостаз, т.е. целостность и равновесие, как самого организма, так и популяции. Принцип Ле Шателье, таким образом, связан с глубокими основами мироздания.
5. Макроскопические тела. Фазовые переходы.
Все, конечно, помнят одно из простых, но весьма важных утверждений школьного курса физики, что вещество может находиться в трех агрегатных состояниях: твердом, жидком и газообразном. Тепловое движение частиц (атомов и молекул) в каждом агрегатном состоянии имеет свои особенности.
В газах обычно расстояние между атомами и молекулами значительно больше размеров молекул. На таких расстояниях силы взаимодействия между частицами практически отсутствуют. Это приводит к тому, что газы легко сжимаются (нет сил отталкивания) и обладают свойством неограниченно расширяться (занимать полностью предоставленный им объем), что равносильно отсутствию сил притяжения. Газ, в котором можно не учитывать силы взаимодействия между частицами и собственный объем частиц, называется идеальным.
В твердом теле молекулы и атомы совершают беспорядочные колебания относительно положений равновесия, в которых силы притяжения и отталкивания со стороны соседних атомов уравновешиваются, т.е. результирующая сила равна нулю. Твердые тела можно разделить на аморфные и кристаллические. В аморфных телах физические свойства (механические, тепловые, электрические, оптические) одинаковы во всех направлениях. В этом проявляется изотропность аморфных тел. Объясняется это тем, что атомы и молекулы в таких телах расположены беспорядочно. В кристаллических телах атомы и молекулы расположены в определенном порядке, поэтому физические свойства таких тел неодинаковы в различных направлениях, т.е. кристаллические тела анизотропны. Если через атомы кристалла мысленно провести линии, то получится решетка, называемая кристаллической.
Жидкости занимают промежуточное положение между твердыми телами и газами. Как показали исследования их структуры, молекулы жидкости некоторое время (т.н. время оседлой жизни) колеблются около положений равновесия. Через некоторое время они перескакивают в новые положения равновесия и колеблются относительно них. Именно эти перескоки молекул и являются причиной текучести жидкости, т.е. ее способности принимать форму сосуда. Взаимное расположение соседних молекул в жидкости в определенной степени упорядочено, но на расстоянии 3..4d, где d – диаметр молекулы, этот порядок нарушается. Вот почему говорят, что в жидкостях существует ближний порядок. (Порядок в кристаллических телах называют дальним).
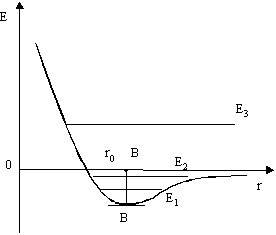
Различие между жидким, твердым и газообразным состоянием можно объяснить и с энергетической точки зрения, воспользовавшись зависимостью потенциальной энергии взаимодействия молекул вещества от расстояния между ними (рис.5).
В состоянии r = r0 потенциальная энергия взаимодействия молекул минимальна.
Значения средней кинетической энергии теплового движения отложим от дна потенциальной ямы В. АВ – глубина потенциальной ямы.
Если средняя кинетическая энергия теплового движения Е1 << АВ, то частицы не могут ее преодолеть и будут совершать колебания около положения равновесия. Тело будет находиться в твердом состоянии.
Если Е ~ АВ, то молекулы будут совершать колебания с большой амплитудой и флуктуации энергии могут привести к выходу их за пределы данной потенциальной ямы и совершать колебания относительно новых положений равновесия. Это соответствует жидкому состоянию вещества.
Если Е>>АВ, то молекулы будут свободно выходить за пределы данной потенциальной ямы, почти не «ощущая» на себе ее влияния, т.е. связи с другими молекулами. Это соответствует газу.
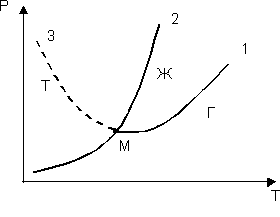
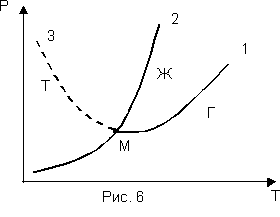
Переходы вещества из одного состояния в другое называются фазовыми переходами I рода. Из сказанного выше ясно, что как агрегатное состояние вещества, так и фазовые переходы определяются внешними условиями: температурой и давлением. При высокой температуре и низком давлении мы имеем газ, при низкой температуре и высоком давлении – твердое тело. Промежуточные условия соответствуют жидкому состоянию. Графически равновесие между жидкостью и ее насыщенным паром, между жидкостью и твердым состоянием можно представить на диаграмме состояния вещества (рис.6).
Если на такой диаграмме построить для данного вещества кривые кипения, плавления и сублимации (испарения твердого вещества), то они пересекутся в одной точке М. В ней одновременно сходятся три фазы: жидкая, твердая, газообразная, поэтому эта точка называется тройной. Диаграмма состояния вещества позволяет предсказывать, в каком состоянии будет находиться вещество при различных условиях, что исключительно важно для практики.
1. Химическая эволюция Земли. Геохронология
2. Понятие самоорганизации в химии
3. Общая теория химической эволюции и биогенеза
4. Теории возникновения жизни
5. Гипотеза Опарина-Холдейна
Ранее уже говорилось о том, что использование ЭВМ позволило строить и рассчитывать образование и развитие солнечной системы и Земли в частности на различных моделях.
Наиболее убедительной выглядит модель образования Солнца и планет из единого вращающегося газопылевого комплекса, т.е. в соответствии с ротационными гипотезами. Вспомним, что согласно этим гипотезам в центре вращающейся газовой туманности образовалась протозвезда – Солнце. Центробежные силы в экваториальной области приводили к возникновению неустойчивых потоков газа и пыли. Впоследствии эта часть вещества была оторвана от Солнца, унося с собой избыточный момент количества движения. Так образовался газопылевой диск (кольцо) в экваториальной плоскости Солнца.
Солнце нагревало внутреннюю часть этого кольца, вызывая испарение и “выгоняя” солнечным ветром более легкие элементы в дальние части кольца. Этот процесс занял во времени около 100 млн. лет. В зависимости от расстояния до Солнца разные части туманности остывали с разной скоростью, что привело к различиям в протекании химических процессов. Химическая эволюция планет и Земли в частности также протекала по-разному: сначала конденсировались наиболее тугоплавкие элементы, а затем летучие. Дальнейшая история развития химических соединений рассматривается нами уже в контексте развития Земли.
1. Химическая эволюция Земли
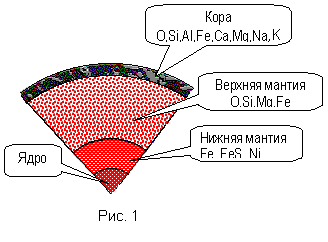
В процессе эволюции Земли складывались определенные пропорции различных элементов. В веществе планет, комет, метеоритов, Солнца присутствуют все элементы периодической системы, что доказывает общность их происхождения, однако количественные соотношения различны. Количество атомов какого-либо химического элемента в различных природных системах принято выражать по отношению к кремнию, поскольку кремний принадлежит к обильным и труднолетучим соединениям.
С ростом порядкового номера распространенность элементов убывает, но не равномерно. Примечательно, что элементы с четным порядковым номером, особенно элементы с массовым числом кратным 4 более распространены. К ним, в частности, относятся He, CO, Ne, Mg, Si, S, Ar, Ca. Дело в том, что этим массовым числам соответствуют устойчивые ядра. Американские космохимики Г. Юри и Г. Зюсс писали по этому поводу следующее: “...распространенность химических элементов и их изотопов определяется ядерными свойствами, и окружающее нас вещество похоже на золу космического ядерного пожара, из которого оно было создано”.
 2014-02-09
2014-02-09 1525
1525








