Таблица 3.17
Изменение активности некоторых ферментов при остроминфаркте миокарда (по И. С. Балаховскому в модификации)
| Фермент | Начало повышенияактивности, ч | Пикувеличения активности, ч | Возвращениек норме,сутки |
| МВ-фракцияКФК | 3–4 | 10–12 | 2 |
| КФК | 6–12 | 3–4 | |
| ЛДГ | 8–10 | 48–72 | 8–14 |
| ЛДГ1 | 8–10 | 24–84 | 10–12 |
| АсАТ | 4–12 | 24–36 | 4–7 |
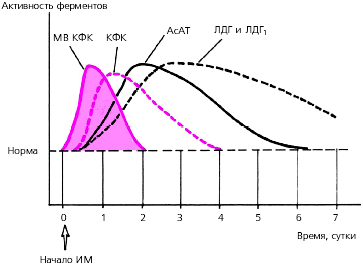
Рис. 3.316. Динамика активности ферментов сыворотки крови при остроминфаркте миокарда. Пунктиром обозначен нормальный уровень ферментов
| Биомаркеры | Время первичного увеличения | Время достижения пиковой концентрации | Длительность повышения |
| Тропонин Т | 3 - 12 ч | 12 ч – 2 дня | 5 – 14 дней |
| Тропонин I | 3 - 12 ч | 24 ч | 5 – 10 дней |
| КФК-МВ (более 25% от общей КФК) | 3 - 12 ч | 24 ч | 2 – 3 дней |
| Миоглобин | 1 - 4 ч | 6 – 7 ч | 24 ч |
Креатинфосфокиназа (КФК). Наиболее специфичнымлабораторным тестом острого ИМ является определение МВ-фракции КФК (МВ-КФК). Ее активность начинаетвозрастать уже через 3–4 ч, достигает максимума через 10–12 ч и возвращается к исходным цифрам через 48 ч от начала ангинозного приступа. Активность общей КФК приИМ претерпевает сходную динамику: уже к концу первых суток уровень фермента в 3–20 раз превышает норму, а через 3–4 суток от начала заболевания возвращается к исходным значениям (рис. 3.316).
Как известно, КФК в большом количестве содержится в скелетных мышцах, миокарде, головном мозге и щитовидной железе. Поэтому увеличение активности этого фермента в сыворотке крови возможно не только при остромИМ, но и при целом ряде других клинических ситуаций:
1. при внутримышечных инъекциях;
2. при тяжелой физической нагрузке;
3. после любого хирургического вмешательства;
4. у больных мышечной дистрофией, полимиозитом, миопатией;
5. при повреждениях скелетных мышц, при травмах,судорожном синдроме, длительной иммобилизации;
6. при инсультах и других повреждениях ткани головного мозга;
7. при гипотиреозе;
8. при пароксизмальных тахиаритмиях;
9. при миокардите;
10. при тромбоэмболии легочной артерии;
11. после проведения коронароангиографии;
12. после электроимпульсной терапии (кардиоверсии) и т. д.
В противоположность этому повышение активности МВ-фракции КФК, содержащейся преимущественно в миокарде,специфично для повреждения сердечной мышцы, в первуюочередь, для острого ИМ. МВ-фракция КФК не реагирует на повреждение скелетных мышц, головного мозга и щитовидной железы. Тем не менее следует помнить, что любые кардиохирургические вмешательства, включаякоронароангиографию, катетеризацию полостей сердца и электроимпульсную терапию, как правило, сопровождаются кратковременным подъемом активности МВ-фракции КФК. В литературе имеются также указания на возможностьповышения уровня МВ-КФК при тяжелой пароксизмальнойтахиаритмии, миокардитах и длительных приступахстенокардии покоя, расцениваемых как проявление нестабильной стенокардии.
Степень повышения активности МВ-КФК в крови в целомхорошо коррелирует с размером ИМ: чем больше объем поражения сердечной мышцы, тем выше активностьМВ-КФК. Следует, однако, иметь в виду, что в ряде случаев при обширных ИМ вымывание ферментов в общий кровоток замедлено, поэтому абсолютное значение активностиМВ-КФК и скорость его достижения могут оказаться меньше, чем при обычном вымывании фермента, хотя и в том, и в другом случае площадь под кривой «концентрация-время» остается одинаковой (рис. 3.317, а, б).
Эти данные послужили основанием для разработки методики неинвазивного определения массы некроза (в граммах) как функции площади под кривой изменения концентрацииМВ-КФК во времени.
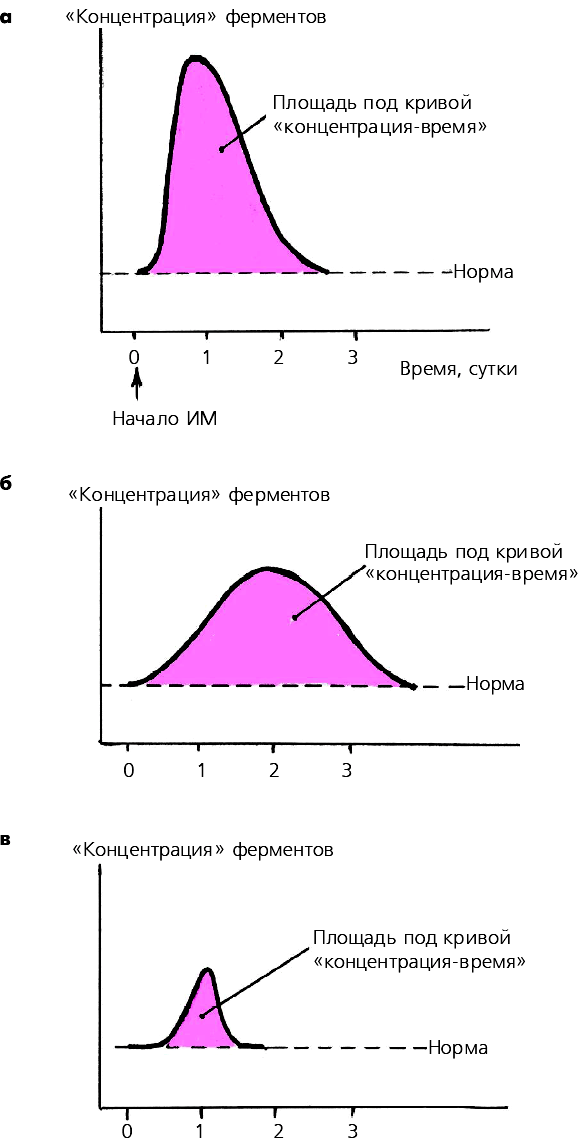
Рис. 3.317. Динамика активности МВ-фракции КФК при обширном трансмуральном (а,б) и интрамуральном (в) инфарктах миокарда.
В двух первых случаях площадь под кривой «концентрация–время»одинакова, хотя пиковые значения
активности МВ-КФК отличаются, что связано с различной скоростьювымывания фермента. При интрамуральном инфаркте миокарда площадь подкривой и максимальная ее амплитуда значительно меньше
Площадь под кривой «концентрация-время» МВ-КФК отражает размеры ИМ, а абсолютные значения активности фермента и время достижения максимума кривой — не только обширность поражения сердечной мышцы, но и скорость вымывания фермента из некротизированного участка сердечной мышцы.
Лактатдегидрогеназа (ЛДГ). Активность этого ферментапри остром ИМ нарастает медленнее, чем КФК и МВ-КФК, и дольше остается повышенной. Пик активности наступает обычно на 2–3 сутки от начала инфаркта, а возвращение к исходному уровню — только к 8–14 суткам.
Следует помнить, что активность общей ЛДГ повышается также при заболеваниях печени, шоке, застойной недостаточности кровообращения, гемолизе эритроцитов и мегалобластной анемии, тромбоэмболии легочной артерии, миокардите, воспалении любой локализации,коронароангиографии, электроимпульсной терапии, тяжелой физической нагрузке и т. д.
В этом отношении изофермент ЛДГ1 более специфичен для поражений сердца, в частности, для острого ИМ, хотя он также присутствует не только в мышце сердца, но и в других органах и тканях, включая эритроциты.
Аспартатаминотранфераза (АсАТ) также относится к числу ферментов с относительно быстро наступающим пиком повышения активности (24–36 ч от начала инфаркта).Через 4–7 суток концентрация АсАТ возвращается к исходному уровню.
Изменение активности АсАТ также неспецифично для острого ИМ: уровень АсАТ вместе с активностью АлАТ повышается при многих патологических состояниях, в том числе при заболеваниях печени. Все же следует помнить, что при поражениях паренхимы печени в большей степени возрастает активность АлАТ, а при заболеваниях сердца —АсАТ. При ИМ коэффициент Ритиса (отношение АсАТ/АлАТ) больше 1,33, а при заболеваниях печени — меньше 1,33.
Учитывая специфические особенности вымывания различных ферментов из очага некроза и длительность их присутствия в сыворотке крови, необходимо помнить о нескольких принципах ферментативной диагностики острогоИМ.
 2014-02-13
2014-02-13 705
705







