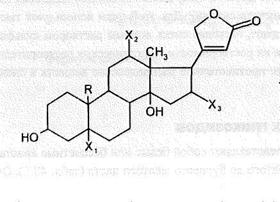
 |
где R-CH 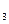 X
X  =X
=X 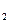 =X
=X 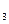 =H и три остатка дигитоксозы, соединенных в положении 3.
=H и три остатка дигитоксозы, соединенных в положении 3.
Фармакологическая группа: Сердечные гликозиды, препарат наперстянки пурпурной, действующий на сердечно-сосудистую систему.
Препараты наперстянки пурпуровой применяют при недостаточности кровообращения II и III стадии различного происхождения, а также при тахисистолической форме мерцательной аритмии, обычно сопровождающей и усугубляющей недостаточность кровообращения. Способ введения зависит от экстренности показаний.
Характеристика структурных фрагментов молекулы.
В листьях наперстянки пурпурной содержатся первичные гликозиды- пурпуреогликозид А и В. При гидролитическом расщеплении, а также при хранении и высушивании под действием энзимов они разрушаются с образованием вторичных гликозидов и продуктов гидролиза. Т.о. образуются дигитоксин и глюкоза. Дигитоксин является вторичным гликозидом.
По химической природе дигитоксин - эфир, в молекуле которого эфирной связью связаны агликон (дигитоксигенин) и сахаристая часть (три молекулы дигитоксозы). Это О-гликозид. Агликон имеет стероидную структуру (карденолид, содержит пятичленный лактонный цикл). При этом прослеживается связь строения с действием, т.к. агликон является носителем биологической активности, а сахар определяет фармакокинетику действующего вещества.
· ИК-спектр, снятый после прессования в таблетки с бромидом калия в области 4000-400 см 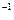 .
.
· УФ-спектр в области 215-220 нм, обусловленный наличием 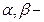 ненасыщенного лактонного кольца.
ненасыщенного лактонного кольца.
· ВЭЖХ
· Фотоколориметрия
· Группа цветных реакций основана на обнаружении пятичленного лактонного цикла с двойной связью в 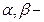 положении в молекуле карденолидов. К их числу относится реакция Легаля, суть которой заключается в образовании окрашенного в красный цвет продукта при взаимодействии сердечного гликозида с раствором нитропруссида натрия в щелочной среде. Эту реакцию ФС рекомендуют для испытания подлинности всех лекарственных препаратов сердечных гликозидов. Пятичленный лактонный цикл можно также обнаружить по образованию окрашенных в красно-фиолетовый цвет продуктов взаимодействия с нитропроизводными ароматического ряда в щелочной среде, например, с м-динитробензолом (реакция Раймонда). Эту реакцию ФС рекомендует для обнаружения агликона в молекуле дигитоксина. Разновидностью данной группы реакций является образование окрашенных в оранжево-красный цвет продуктов взаимодействия сердечный гликозидов со щелочным раствором пикриновой кислоты (реакция Балье):
положении в молекуле карденолидов. К их числу относится реакция Легаля, суть которой заключается в образовании окрашенного в красный цвет продукта при взаимодействии сердечного гликозида с раствором нитропруссида натрия в щелочной среде. Эту реакцию ФС рекомендуют для испытания подлинности всех лекарственных препаратов сердечных гликозидов. Пятичленный лактонный цикл можно также обнаружить по образованию окрашенных в красно-фиолетовый цвет продуктов взаимодействия с нитропроизводными ароматического ряда в щелочной среде, например, с м-динитробензолом (реакция Раймонда). Эту реакцию ФС рекомендует для обнаружения агликона в молекуле дигитоксина. Разновидностью данной группы реакций является образование окрашенных в оранжево-красный цвет продуктов взаимодействия сердечный гликозидов со щелочным раствором пикриновой кислоты (реакция Балье):
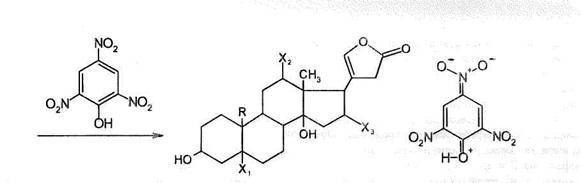
· Реакция обнаружении сахарного компонента. Для этой цели могут быть использованы свойственные сахарам реакции, основанные на их восстановительных свойствах (реакция с реактивом Фелинга, реакция «серебряного зеркала» и др.). Но наиболее широко применяют специфичную на 2-дезоксисахара (содержащиеся в молекулах большинства сердечных гликозидов) реакцию Келлера-Килиани. Из различных способов ФС рекомендует методику, заключающуюся в предварительном растворений 1-2 мг гликозида в ледяной уксусной кислоте, содержащей 0,05%-ного хлорида железа (III). Раствор осторожно вливают в пробирку с концентрированной серной кислотой и наблюдают окраску верхнего слоя, подтверждающую наличие в молекуле сахара — дигитоксозы (сине-зеленый цвет) и наличие агликона — дигитоксигенина по окраске на границе двух слоев (лилово-красной или бурой). Этим способом устанавливают подлинность дигитоксина.
· Подлинность сердечных гликозидов можно подтвердить по удельному вращению.
Рациональные условия хранения:
Лекарственные препараты сердечных гликозидов хранят по списку А, в хорошо укупоренной таре, предохраняющей от действия света и влаги. Такие условия позволяют не допускать их гидролитического расщепления.
Большое влияние на стабильность гликозидов, особенно в растительном сырье, оказывают ферменты. Поэтому при его хранении и получении лекарственных веществ ферменты необходимо инактивировать. Это достигается путём высушивания сырья при 40-60 °С или обработки его парами этанола, эфира, хлороформа. После этого стабильность гликозидов значительно повышается.
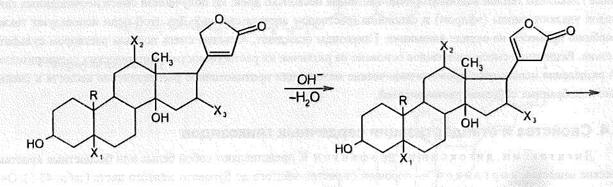
Сердечные гликозиды, как правило, являются нейтральными соединениями. Они чувствительны к воздействию как кислот, так и щелочей. Под влиянием кислот, даже таких слабых, как уксусная, происходит отщепление легко гидролизуемых 2-дезоксисахаров, являющихся составными компонентами сердечных гликозидов. В щелочной среде происходит необратимая изомеризация карденолидов или расщепление лактонного цикла с образованием фармакологически неактивных соединений. Под влиянием щелочи в лактонном цикле может происходить перемещение двойной связи из 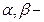 положения в
положения в 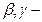 положения. Процесс гидролиза гликозидов сопровождается последовательным отщеплением моносахаридов, входящих в состав сахарного компонента. Установить стабильность сердечных гликозидов можно no отсутствию восстановительной способности, т.к.. у них замещен полуацетальный гидроксил.
положения. Процесс гидролиза гликозидов сопровождается последовательным отщеплением моносахаридов, входящих в состав сахарного компонента. Установить стабильность сердечных гликозидов можно no отсутствию восстановительной способности, т.к.. у них замещен полуацетальный гидроксил.
 2015-01-30
2015-01-30 5886
5886







