1. Периодический закон и периодическая система химических элементов Д. И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.



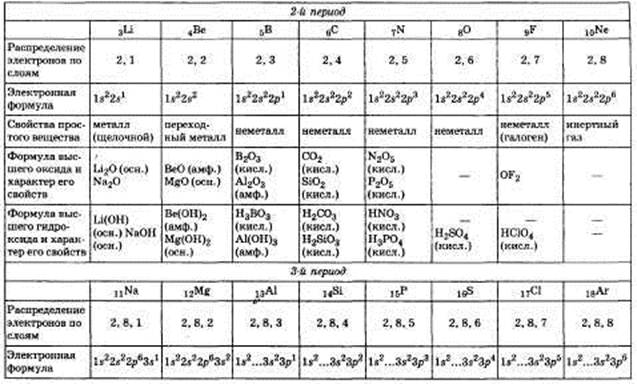

2. Строение атомов химических элементов и закономерности в изменении их свойств на примере: а) элементов одного периода; б) элементов одной главной подгруппы.





3. Виды химической связи: ионная, металлическая, ковалентная (полярная и неполярная); простые и кратные связи в органических соединениях.







4. Классификация химических реакций в неорганической и органической химии.





5. Химическое равновесие и условия его смещения: изменение концентрации реагирующих веществ, температуры, давления.




6. Скорость химических реакций. Зависимость скорости от природы, концентрации веществ, температуры, катализатора.





7. Реакции ионного обмена. Условия их необратимости.


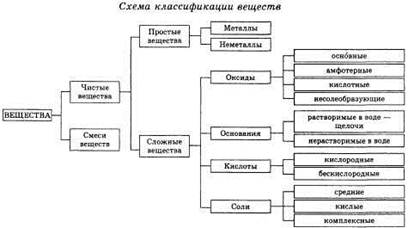
8. Важнейшие классы неорганических соединений.



9. Металлы, их положение в периодической системе химических элементов Д. И. Менделеева, строение их атомов, металлическая связь. Общие химические свойства металлов.



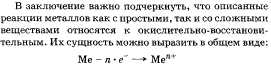
10. Неметаллы, их положение в периодической системе химических элементов Д. И. Менделеева, строение их атомов. Окислительно-восстановительные свойства неметаллов на примере элементов подгруппы кислорода.




11. Аллотропия неорганических веществ на примере углерода и кислорода.




12. Электрохимический ряд напряжений металлов. Вытеснение металлов из растворов солей другими металлами.



13. Водородные соединения неметаллов. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе Д. И. Менделеева.




14. Высшие оксиды химических элементов третьего периода. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе.



15. Кислоты, их классификация и свойства на основе представлений об электролитической диссоциации.


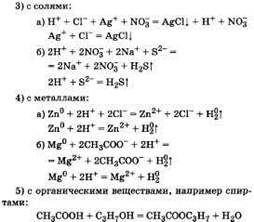
16. Основания, их классификация и свойства на основе представлений об электролитической диссоциации.

17. Соли, их состав и название; взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена.



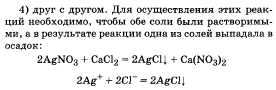
18. Химическая и электрохимическая коррозия металлов. Условия, при которых происходит коррозия, меры защиты металлов и сплавов от коррозии.




19. Окислительно-восстановительные реакции (на примере взаимодействия алюминия с оксидами некоторых металлов, концентрированной серной кислоты с медью).



20. Окислительно-восстановительные свойства серы и ее соединений.



21. Железо: положение в периодической системе химических элементов Д. И. Менделеева, строение атома, возможные степени окисления, физические свойства, взаимодействие с кислородом, галогенами, растворами кислот и солей. Сплавы железа.




22. Теория электролитической диссоциации. Степень диссоциации.
Растворы всех веществ можно разделить на две группы: электролиты -проводят электрический ток, неэлектролиты -проводниками не являются. Это деление является условным, потому что все растворы веществ проводят электрический ток, все они в той или иной мере растворяются в воде и распадаются на катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы). Следует различать настоящие и потенциальные электролиты.
Настоящие электролиты находятся в виде ионов уже в индивидуальном состоянии, т.е. до того, как они будут расплавлены или переведены в раствор. К настоящим электролитам относятся все типичные соли, которые в твёрдом состоянии образуют ионную кристаллическую решётку (например NaCl, K2SO4 и т.д.)
Потенциальные электролиты в индивидуальном состоянии ионов не содержат, но образуют их при переходе вещества в раствор. К ним относятся вещества, состоящие из молекул с сильно полярными связями (например HCl).
К неэлектролитам относится большая часть органических соединений, например диэтиловый эфир, бензол, глюкоза, сахароза.
Заряженные частицы появляются только в растворах и расплавах веществ вследствие электролитической диссоциации. Электролитическая диссоациация-это процесс распада веществ на ионы при растворении или расплавлении.
Следовательно, в результате диссоциации в растворе появляются ионы, которые являются предпосылкой для появления у раствора или расплава такого физического свойства как электропроводимость.
Как же происходит процесс растворения?. Разрушение ионной кристаллической решётки происходит под воздействием растворителя, например воды. Полярные молекулы воды настолько снижают силы электростатического притяжения между ионами в кристаллической решётке, что ионы становятся свободными и переходят в раствор.
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Теорию электролитической диссоциации создал в 1884-1887 гг. шведский химик Аррениус.Эта классическая теория позволила как электропроводимость расплавов и растворов, так и протекание химических реакций в растворах между расплавленными или растворёнными веществами.
 2015-01-30
2015-01-30 5670
5670







