Реакции комплексообразования сопровождаются переносом электронных пар и приводят к образованию или разрушению комплексных (координационных) соединений. Особенностью комплексных соединений является наличие в них координационной связи, возникшей по донорно-акцепторному механизму:
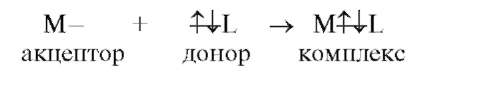
Центральный атом (комплексообразователь ) - атом или ион, который занимает центральное положение в комплексном соединении. Роль комплексообразователя чаще всего выполняют частицы, имеющие свободные орбитали и достаточно большой положительный заряд ядра, а следовательно, могут быть акцепторами электронов.
Число мест, занимаемых каждым лигандом во внутренней сфере комплексного соединения, называется координационной емкостью (дентатностью ) лиганда.
Природа химической связи в комплексных соединениях: Образование многих комплексных соединений можно в первом приближении объяснить электростатическим притяжением между центральным катионом и анионами или полярными молекулами лигандов. Наряду с силами притяжения действуют и силы электростатического отталкивания между одноименно заряженными лигандами. В результате образуется устойчивая группировка атомов(ионов), обладающая минимальной потенциальной энергией.
|
|
|
Наиболее устойчивые и разнообразные комплексы по составу и выполняемым ими функциям образуют d-элементы. Особенно большое значение имеют комплексные соединения переходных элементов: железа, марганца, титана, кобальта, меди, цинка и молибдена. Биогенные s-элементы (Na, К, Mg, Са) образуют комплексные соединения только с лигандами определенной циклической структуры, выступая также в качестве комплексообразователя. Основная часть р -элементов (N, P, S, О) является активной действующей частью комплексообразующих частиц (лигандов), в том числе и биолигандов. Следовательно, способность к комплексообразованию - это способность уменьшается в следующем порядке: f > d > p > s.
30.. Пространственное строение комплексных соединений. Классы комплексных соединений. Пространственное строение комплекса определяется типом гибридизации атомных орбиталей центрального атома. Комплексные соединения с координационным числом 2 встречаются редко(sp-гибридизация).пример:[Ag(NH3)2]+. Наиболее распространены комплексы с координационными числами 4 и 6. Для описания геометрии комплексных соединений пользуются понятием координационных полиэдров(многогранник.вершинами которого служат лиганды, связанные с центральным атомом-комплексообразователем. Комплексы с координационным числом 4 могут быть как тетраэдрическими(sp3-гибридизация)пример:[Zn(NH3)4]2+ , так и плоскоквадратными(dsp2-гибридизация)пример:[Pt(NH3)4]2+. Комплексы с координационным числом 6 имеют октаэдрическую конфигурацию(d2sp3-гибридизация).Пример:[Ni(NH3)6]3+. Реже встречаются комплексы с координационным числом 5(dsp3-гибридизация). Они образуют тригональную бипирамиду(пример:[CdCI5]3-) или квадратную пирамиду.(пример:[Ni(CN)5]3-). Координационному числу 12(очень редко) соответствует икосаэдр.
|
|
|
Впервые правильные представления о пространственном строении комплексных соединений были сформулированы А.Вернером. При этом он исходил из найденного опытным путем числа изомеров при наличии двух или более различных лигандов в комплексе и сравнивал его с возможным числом для той или иной предполагаемой конфигурации. Так,для координационного числа 4 и тетраэдрической конфигурации все положения лигандов относительно центрального атома эквивалентны. Например,в одном из изомеров комплекса [Pt(NH3)2Cl2] атомы хлора разделены центральным атомом(транс-изомер),а в другом(цис-изомер) они находятся рядом друг с другом,по одну сторону от центрального атома.
Cl- NH3 Cl-
Pt2+ Pt2+
H3N Cl- Cl-
По знаку заряда комплекса различают:
1)Катионные комплексы - [Co(NH3)6]Cl3
2)анионные комплексы - Li[AlH4], K2[Be(CO3)2]
3)нейтральные комплексы - [Pt(NH3)2Cl2], [Co(NH3)3Cl3].
Нейтральные комплексы не имеют внешней сферы.
Особую группу составляют сверхкомплексные соединения. В них число лигандов превышает координационную валентность. Примером может служить CuSO4·5H2O. У меди координационная валентность равна четырем и во внутренней сфере координированы четыре молекулы воды. Пятая молекула присоединяется к комплексу при помощи водородных связей.
31. Комплексоны — органические вещества,которые образуют комплексные соединения с ионами металлов. Их используют в качестве антидотов при отравлении. В медицинской практике наиболее широко используют комплексон — этилендиаминтетрауксусную кислоту,,которая известна еще как трилон А, а ее натриевая соль — трилон Б. Соли комплексонов называются комплексонатами. Они хорошо растворимы и характеризуются большими константами устойчивости.
Ионные равновесия в растворах комплексных соединений. Комплексные соединения диссоциируют в растворах как сильные электролиты на внешнюю и внутреннюю сферы,поскольку они связаны между собой ионным типом связи [Cu(NH3)4]SO4→[Cu(NH3)4]2++ SO4-,
К2[Zn(СN)4] →2К++ [Zn(СN)4]2-
Количественно диссоциацию комплексных ионов,как и слабых электролитов,можно оценить константами равновей или общими константами нестойкости. Общая константа нестойкости Кн равна произведению ступенчатых констант нестойкости: Кн = Кн1 * Кн2
Например:
[Ag(NH3)2]+↔[Ag(NH3)]++ NH3Кн1 (1)
[Ag(NH3)]+↔Ag++ NH3Кн2 (2)
[Ag(NH3)2]+↔Ag++ 2NH3Кнобщ
.
Кн1 = [Ag(NH3)]+[NH3]/[Ag(NH3)2+] = 1,2 * 10-4
Кн2 = [Ag+][NH3]/[Ag(NH3)+] = 4,8 * 10-4
Кн.общ = [Ag+][NH3]2/[Ag(NH3)2] = 5,8 * 10-8
На диссоциацию комплексного иона влияют все факторы,действующие на равновесие.
Для комплексных соединений характерными являются реакции внутрисферного замещения. Так,в соединении K2[PtCl6] можно заместить хлорид-ионы гидроксидными группами при постепенном добавлении раствора щелочи [PtCl6]2-→[Pt(ОH)Cl5]2-→[Pt(ОH)2Cl4]2-→... [Pt(ОH)5Cl]2-→[Pt(ОH)6]2-
Определяемая на основе закона действующих масс константа равновесия называется константой устойчивости комплекса: Ку = [Mln]/[M][L]n
Чем больше равновесие сдвинуто вправо,в сторону образования комплекса,тем больше равновесная концентрация и больше константа устойчивости.
Величина,обратная константе устойчивости комплекса,называется константой нестойкости этого комплекса:
Кн = 1/Ку = [M][L]n/[MLn]
Устойчивость координационных соединений зависит как от природы центрального атома,так и от природы связанных с ним лиганд.
32. К блоку s-элементов относятся 13 элементов,общим для которых является застраивание в их атомах s-подуровня внешнего энергетического уровня. В группу IА входят 7 элементов: литий,калий,натрий,рубидий,цезий,франций,водород. Электронная формула внешней оболочки элементов ns1,они имеют на внешнем энергетическом уровне по одному s-электрону,соответственно,устойчивая степень окисления щелочных металлов равна +1.
|
|
|
Общая характеристика: легко отдают валентные s-электроны,являются сильными восстановителями,щелочными металлами,обладающими блеском,высокой электрической проводимостью и теплопроводностью,химически весьма активны. Образуют соединения с ионным типом связи(искл:водород).Низкая энергия ионизации.
Биологическая роль Na,K: Содержания Na в организме человека составляет около 60г. Остальное количество находится в костной ткани. Поддерживает осмотическое давление и pH среды,вместе с калием формирует электрический потенциал мембран клеток, за счет которого передается сигнал в нервных клетках, мышечных клетках,участвует в транспорте через мембраны клеток неорганических и органических анионов,участвует в переносе оксида углерода в крови.Содержание К в организме человека составляет примерно около 160г. Калия является основным внутриклеточным катионом. Калий вместе с другими важнейшими электролитами обеспечивает необходимое осмотическое давление в биологических жидкостях организма и в клетках, является компонентом буферных систем, поддерживает электрический потенциал на мембранах клеток всех тканей. Главная биологическая функция калия — формирование совместно с другими электролитами разницы потенциалов на мембранах клеток и передача ее изменения по клеточной мембране, за счет обмена с ионами натрия, что особенно важно для нервных и мышечных клеток.
Важнейшие соединения Na. Гидрид натрия NaH,Оксид натрия Na2O,Пероксид натрия Na2O2,Надпероксид натрия NaO2,Гидроксид натрия NaOH.Фторид натрия NaF,Хлорид натрия (каменная соль, поваренная соль) NaCl,Бромид натрия NaBr,Иодид натрия NaI,Сульфид натрия Na2S,Сульфит натрия Na2SO3,Сульфат натрия Na2SO4,Тиосульфат натрия Na2S2O3,Нитрит натрия NaNO2,Нитрат натрия (чилийская селитра) NaNO3,Ортофосфат натрия Na3PO4,Безводный (кальцинированный) карбонат натрия Na2СO3,Кристаллический карбонат натрия (сода) Na2СO3 * H2O
|
|
|
Важнейшие соединения K. Гидрид калия KH,Оксид калия K2O,Пероксид калия K2O2,Гидроксид калия KOH,Фторид калия KF,Хлорид калия Kcl,Бромид калия Kbr,Иодид калия KI,Хлорат калия (бертолетова соль) KClO3,Сульфид калия K2S,Сульфит калия K2SO3,Сульфат калия K2SO4,Нитрат калия (селитра) KNO3,Ортофосфат калия K3PO4,Карбонат калия K2СO3,Цианид калия KCN. Качественные реакции катионов Na+. 1.Реакция с дигидроантимонатом калия (или гексагидроксостибатом (V) калия). Реакция применяется для осаждения ионов натрия из сыворотки крови или плазмы при подометрическом определении натрия в крови.
Na++ KH2Sb04= NaH2Sb04| + К+
Na++ [Sb (OH)6]- = Na[Sb (OH)6] бел. крист.,
2. Микрокристаллическая реакция с цинкуранилацетатом
Na++ Zn(UO:)3(CH3COO)8+СН3СОО-+ 9Н2О = NaZn(UO2)3(CH3COO)9-9H2O желт, октаэдрич. крист., (р.- уксусн. к-та)
Качественные реакции К+ 1. Реакция с гидротартратом натрия или (винной кислотой) в присутствии ацетата натрия (рН=7)
К+ + NaHC4H4O6= КНС4Н4О61 бел. крист.+ Na+
2. Реакция с гексанитрокобальтатом (III) натрия (рНлюбая кроме сильных кислот и сильных щелочей, т.к. реагент разлагается)
2К++ Na3[Co(NO:)6] = K2Na[Co(NO2)6] [ желт, крист., (р.- мин. к-ты)+ 2Na+ 3.
Реакция с гексанитрокупратом (II) натрия и свинца.
2К++ Na2Pb[Cu(NO2)6] = K2Pb[Cu(NO,)6] | черн. кубические крист. + 2Na+
33. К блоку s-элементов относятся 13 элементов,общим для которых является застраивание в их атомах s-подуровня внешнего энергетического уровня. В группу IIА входят 6 элементов: бериллий,магний,кальций,стронций,барий,радий. Электронная формула внешней оболочки элементов ns2 ,они имеют на внешнем энергетическом уровне по два валентных электрона. В нормальном состоянии у атомов этих элементов нет неспаренных электронов,но при переходе атомов в возбужденное состояние один из s-валентных электронов переходит на р-подуровень. Это и обусловливает проявление степени окисления +2. Общая характеристика: легко отдают валентные s-электроны,являются сильными восстановителями,обладающими блеском,высокой электрической проводимостью и теплопроводностью,химически весьма активны. Легко окисляются на воздухе,высокая температура плавления,легкие элементы(искл.радий).
Биологическая роль Ca,Mg: Магний относится к макроэлементам. Общее содержание его в организме около 20г. В наибольшей степени магний концентрируется в дентине и эмали зубов,костной ткани. Накапливается в поджелудочной железе,скелетных мышцах,почках,мозге,печени и сердце. Является внутриклеточным катионом. Играет значительную роль при передаче нервных импульсов и необходим для ритмичной работы сердца.
Кальций относится к макроэлементам. Основная масса кальция находится в костной и зубной тканях. Также кальций регулирует проницаемость клеточных мембран, а также инициирует ответы клеток на различные внешние стимулы. Присутствие кальция в клетки или во внеклеточной среде обуславливает дифференцировку клетки, а также сокращение мышц, секрецию и перистальтику. Кальций регулирует активность многих ферментов (включая ферменты систем свертывания крови).
Биологический антагонизм: наблюдается при сокращении мышцы. Ионы Ca2+ принимают участие в сокращении мышцы, а ионы Mg2+ принимают участие в расслаблении мышцы. Также, при длительном поступлении в организм избыточных количеств солей Mg наблюдается усиленноевыделения Ca из костной ткани. Важнейшие соединения Ca Гидрид кальция СаН2,Оксид кальция (жженая или негашеная известь) СаО,Пероксид кальция СаО2,Надпероксид кальция СаО4Гидроксид кальция (гашеная известь) Са(ОН)2Фторид кальция CaF2Хлорид кальция CaСl2Бромид кальция CaBr2Иодид кальция CaI2.,Хлорная известь CaOCl2,Сульфид кальция CaS.,Сульфат кальция CaSO4,Нитрид кальция Ca3N2,Амид кальция Ca(NH2)2,Нитрат кальция Ca(NO3)2,Ортофосфат кальция Ca3(PO4)2,Карбид кальция CaC2,Карбонат кальция CaCO3 Важнейшие соединения Mg Гидрид магния MgH2,Оксид (белая магнезия, жженая магнезия) магния MgO,Гидроксид магния Mg(OH)2,Фторид магния MgF2,Хлорид магния MgCl2,Бромид магния MgBr2,Иодид магния MgI2,Сульфид магния MgS,Сульфат магния MgSO4,Нитрат магния Mg(NO3)2,Карбонат магния MgCO3
Качественные реакции катионов Са2+
1. Реакция с сульфат – ионами
Са2++ SО42-+ 2Н2О = СаSО42Н2О Осадок нерастворим в кислотах и щелочах, но растворяется:. А) в насыщенном водном растворе сульфата аммония с образованием комплекса (NH4[Са(SО4)2])
Са2+от Sr2+и Ва2+;
CaSO4+ (NH4)2SO4=(NH4)2[Ca(SO4)2]
2. Реакции с оксилатом аммония
Са2++ С2О42-= Са С2О4
Осадок нерастворим в растере аммиака, но растворяется в разбавленных минеральных кислотах с образованием щавелевой кислоты.. 3 Реакция с углекислый натрием (Na2CO3)
Са2++ Na2CO3 = Са CO3(белый)+ NH4
Осадок СаСО3легко растворяется в минеральных и уксусной кислотах.4. Реакция с гексацианоферратом (II) калия
Са2++ 2NH4++ [Fe(CN)6]4-= (NH4)2Ca[Fe(CN)6]
Выпадает белый кристаллический осадок, который не растворяется в уксусной кислоте.5.Реакция с гидрофосфатом натрия (Na 2НРО4)
Са2++НРО42-= Са НРО4(белый)
6. Реакция с родзинатом натрия
Na2C6O6+ 2 Са2++ 2 ОН-= Са C6O6(ОН)2+ 2Na+(фиолетовый, растворим в НС1)
Качественные реакции катионов Ва2+ 1. Реакция с серной кислотой и растворимыми сульфатами.
Ва2++ SO42- = BaSO4
Осадок нерастворим в щелочах и кислотах, за исключением концентрированной H2SO4, в которой он заметно растворяется с образованием гидросульфата бария:
BaSO4+ H2SO4-> Ba(HSO4)2.
2. Реакция с родизонатом натрия. в нейтр. среде:
Ва2++ Na2C6O6= ВаС6Об 1+2 Na+(красно-бур.)
в кисл. среде:
Ва2++ 2 Na2C6O6+ 2 Н+= Ва(НС6О6)2+ 4 Na+(ярко красн.)
3. Реакция с хроматом и дихроматом калия.
Ва2++ СгО42- = Ва СгО 4(желтый кристаллический)
2 Ва2++ Сг,О72- + 2 СН3СОО- + НОН = 2 ВаСгО4+ 2 CH3COOН
Качественные реакции катионов Mg 1. Реакция с щелочами и аммиаком: Mg2++ 2 ОН- —> Mg(OH)2(белый аморфный)
Mg2+ + 2 NHrH2O = Mg(OH)2+ 2 NH4+
Осадок не растворяется в щелочах, растворяется в НС1, H2SO4, CH3COOH: Mg(OH)2+ 2 Н+-► Mg2++ 2 Н2О
2. Реакция с гидрофосфатом натрия Na2HPO4
Mg2++ НРО42- + NH3-- NH4MgPO4| (белый кристаллический) При проведении реакции в отсутствии катионов аммония и аммиака выпадает белый аморфный осадок MgHPO4. Избыток NH4мешает выпадению NH4MgPO4. Осадок NH4MgPO4растворяется в минеральных кислотах и в уксусной кислоте:
NH4MgPO4+ 3 НС1 - Н3РО4+ MgCl2+ NH4C1
NH4MgPO4+ 2 CHjCOOH = NH4H2PO4+ (CH3COO)2Mg
3. Реакция с растворимыми карбонатами (Nа2С03).
2 Mg2++ 2 Nа2С03+ Н2О = (МgОН)2С0з(белый аморфный) +4 Nа + СО2. Осадок (МgОН)2С0з,растворим в кислотах и в солях аммония.
4. Реакция с оксалатом аммония (NH4)С2О4.
Mg2++ (NH4)С2О4= Mg С2О4(белый) + 2 NH4
34 К d-блоку относятся 32 элемента периодической системы. D-элементы входят в 4-7 большие периоды. В IБ-группе находятся переходные металлы:медь,серебро,золото, которые имеют сходное распределение электронов.
Электронные структуры: могут отдавать от 1 до 3 электронов. Для меди наиболее устойчивы степени окисления +1 и +2,для серебра +1.
Общая характеристика: Образуют комплексные соединения с разнообразными лигандами. Переменная валентность,разнообразие степеней окисления. С увеличением атомного номера в группах Б металлические свойства уменьшаются,увеличиваются окислительные свойства,возрастает энергия ионизации.
Важнейшие соединения Cu: Гидрид меди (I) CuH,Оксид меди (I) Cu2O,Гидроксид меди (I) CuOH,Фторид меди (I) CuF,Хлорид меди (I) CuCl,Бромид меди (I) CuBr,Иодид меди (I) CuI,Сульфид меди (I) Cu2S,Сульфат меди (I) Cu2SO4,Оксид меди (II) CuO,Гидроксид меди (II) Cu(OH)2,Фторид меди (II) CuF2,Хлорид меди (II) CuCl2,Бромид меди (II) CuBr2,Сульфид меди (II) CuS,Сульфат меди (II) CuSO4
Важнейшие соединения Ag: Оксид серебра (I) Ag2O,Гидроксид серебра (I) AgOH,Фторид серебра (I) AgF,Хлорид серебра (I) AgCl,Бромид серебра (I) AgBr,Иодид серебра (I) AgI,Сульфид серебра (I) Ag2S,Сульфат серебра (I) Ag2SO4,Тиосульфат серебра (I) Ag2S2O3,Нитрат серебра (I) AgNO3,Ортофосфат серебра (I) Ag3PO4,Карбонат серебра (I) Ag2CO3,Цианид серебра (I) AgCN,Оксид серебра (II) AgO,Фторид серебра (II) AgF2
 2015-01-30
2015-01-30 1105
1105








