
|
Молекулы ПАВ состоят из двух частей: полярной (гидрофильной) и неполярной (гидрофобной). При адсорбции полярная группа, обладающая большим сродством с полярной фазой (например, с водой) втягивается в нее. В то же время неполярная группа выталкивается в неполярную фазу.
При малых концентрациях ПАВ углеводородные радикалы «лежат» на поверхности полярной жидкости, а полярные группировки погружены в нее. С увеличением концентрации ПАВ в растворе число молекул, находящихся в поверхностном слое, возрастает. Это приводит к образованию на граничной поверхности насыщенного мономолекулярного адсорбционного слоя, в котором молекулы ПАВ предельно ориентированы. Данный слой образно называется молекулярным частоколом Лэнгмюра..
Представления об ориентации молекул ПАВ в насыщенном адсорбционном слое сыграли большую роль в развитии учения о структуре биологических мембран
 Клеточные мембраны образованы главным образом молекулами двух типов: липидами и белками.
Клеточные мембраны образованы главным образом молекулами двух типов: липидами и белками.
Липиды нерастворимы в воде, но растворимы в органических растворителях. Особенностью мембранных липидов является то, что на одном конце их молекулы есть полярные группы (например, –СООН), обладающие гидрофильными свойствами, тогда как другой ее конец представляет собой длинную углеводородную цепь с гидрофобными свойствами. Липиды образуют бимолекулярные пленки в которых полярные группы располагаются на обеих поверхностях мембраны, а неполярные погружены внутрь ее.
|
|
|
Молекулы белка могут располагаться вблизи внешней и внутренней поверхностей мембраны, а также проникать, частично или полностью, через всю ее толщину.
Обычно клеточные мембраны весьма прочны и обладают свойствами электрического изолятора.
Значение поверхностных явлений в медицине. Вода – наиболее часто применяющийся растворитель. Она обладает большим поверхностным натяжением, поэтому по отношению к ней многие вещества являются поверхностно-активными.
Изменение поверхностного натяжения биологических жидкостей используется в диагностических целях. К примеру, поверхностное натяжение плазмы крови значительно изменяется при различных заболеваниях (анафилактический шок, рак и др.). С возрастом человека поверхностное натяжение сыворотки крови уменьшается.
23. Физическая адсорбция и хемосорбция (ПРОВЕРИТЬ!)
На поверхности раздела двух фаз помимо адсорбции, обусловленной в основном физическими взаимодействиями, может идти химическая реакция. Этот процесс называется хемосорбцией. «Обычную» адсорбцию в случае, когда требуется подчеркнуть природу сил взаимодействия, называют физической адсорбцией. Чёткое разделение на адсорбцию и хемосорбцию не всегда возможно. Одним из основных параметров, по которым различаются эти явления является тепловой эффект: так, тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата, тепловой эффект хемосорбции значительно выше. Кроме того в отличие от адсорбции хемосорбция обычно является необратимой и локализованной. Примером промежуточных вариантов, сочетающих черты и адсорбции и хемосорбции является взаимодействие кислорода на металлах и водорода на никеле: при низких температурах они адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать хемосорбция.
|
|
|
Причиной адсорбции являются неспецифические Ван-дер-Ваальсовы силы.
Физическая адсорбция является обратимым процессом, условие равновесия определяется равными скоростями адсорбции молекул адсорбтива P на вакантных местах поверхности адсорбента S* и десорбции — освобождения адсорбата из связанного состояния S − P:
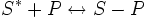 ;
;
уравнение равновесия в таком случае:
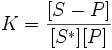 ,
,
Количественно процесс физической мономолекулярной адсорбции описывается уравнением Ленгмюра:
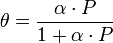
Явление смачивания твердых тел жидкостями убеждает нас в том, что молекулы жидкости в некоторых случаях как бы прилипают к твердому телу и более или менее длительно удерживаются на нем. То же может происходить и с молекулами газа. Твердое тело, находящееся в газе, всегда покрыто слоем молекул газа, некоторое время удерживающихся на нем молекулярными силами, Это явление носит название адсорбции. Количество адсорбированного газа в разных случаях разное. Прежде всего, оно зависит от площади поверхности, на которой могут адсорбироваться молекулы: чем больше эта поверхность, тем больше адсорбируется газа. Адсорбирующая поверхность особенно велика у пористых веществ. Количество адсорбированного газа зависит также от природы газа и от свойств твердого тела.
Уравнение Ленгмюра является одной из форм уравнения изотермы адсорбции. Под уравнением изотермы адсорбции понимают зависимость равновесной величины адсорбции от концентрации адсорбтива a=f(С) при постоянной температуре. Концентрация адсорбтива для случая адсорбции из жидкости выражается в мольных, либо массовых долях. В случае адсорбции из растворов, пользуются относительной величиной: С/Сs. В случае адсорбции из газовой фазы концентрация может быть выражена в единицах абсолютного давления в относительных единицах: P/Ps. Саму величину адсорбции можно выразить также в единицах концентрации. Для адсорбции на твёрдых адсорбентах, особенно при рассмотрении практических задач, используют отношение массы или количества поглощённого вещества к массе адсорбента, например мг/г или ммоль/г.
 2015-01-30
2015-01-30 1187
1187








