Cu(OH)2+ 2NaOH = Na2[Cu(OH)4].
Для меди (I) аквакомплексы неустойчивы, устойчивы амминокомплексы типа [Cu(NH3)2]+, гидроксокомплексы [Cu(OH)2]-и хлоридные комплексы [CuCl2]-.
Качественные реакции катионов Ag+
1. Реакции с растворимыми хлоридами, бромидами, йодидами
Ag+-CL = Ag CL
Ag+-Br = Ag Br (св-желт, ч. р.-в NH3)
Ag++ I = Agl (желт, н.р.-в NH3)
2.Реакция с хромат - ионами CrO4' (pH=7)
2Ag++ CrO42- = Ag2Cr04(кирпично-красн., р.- в NH}, o6paзуя [Ag(NH3)2]2CrO4).
3.Реакция со щелочами и гидрофосфатом натрия.
2 Ag4+ 2 ОН- = Ag2Q | (бур. или черн.) + Н2О 3 Ag++ 2 РО42--= Ag3PO4I (желтоватый) + Н2РО4-
4.Микрокристаллическая реакция с К2Сг2О7
2 Ag++ K2Cr207= Ag2Cr2071 (крас.-бур или оранж. кристалы)+ 2 К+
Качественные реакции катионов Cu2+
1.Реакция с щелочами.
Си2++ 2 ОН-— Си(ОН), сине-зеленый)
Смесь осторожно нагревают до кипения и кипятят до потемнения осадка. Си(ОН)2 разлагается, теряя воду и образуется черный осадок оксида меди (II) СиО.
2.Реакция с аммиаком
СиСl + NHrH2O — Си(ОН)С1 |(сине-зеленый) В избытке аммиака осадок растворяется с образованием ярко синего раствора:
Си(ОН)С1 + 4 NH3-H2O — [Cu(NH3)4]2++ ОН- + СГ + 4 Н2О
|
|
|
3.Реакция с гексацианоферратом (II) калия.
2Cu2++ [Fe(CN)6]4- — Си2[Ре(СЫ)6]|(красно-коричневый).
Осадок не растворяется й разбавленных кислотах, но растворяется в 25%-м водном аммиаке:
Cu,[Fe(CN)6] + 12 NH3+ 4 Н2О — (NH4)4[Fe(CN)6] + 2 [Cu(NH3)4](OH)2
4. Реакция с купроном (1-бензоиноксимом).
С6Н5- СН - ОН
I СМ, - С = NOH
Cu2++ H2L + 2 Н2О — СиЦН2О)21(зеленый хлопьевидный) + 2 Н+
35.К d-блоку относятся 32 элемента периодической системы. D-элементы входят в 4-7 большие периоды.
Электронные структуры: эл.формула Cr: 1s 22s 22p 63s 23p64s 13d5, Mn: 1s 22s 22p 63s 23p64s 23d5. У атома хрома на 4 s -подуровне не два, как этого следовало бы ожидать, а только один электрон. Зато на 3 d -подуровне пять электронов. А у марганца Mn на 3 d -орбитали располагаются уже пять электронов. Принадлежащие марганцу семь внешних (валентных) электронов 4 s2 и 3 d5 и определяют его химические свойства.
Важнейшие соединения Cr: Оксид хрома (II) CrO,Гидроксид хрома (II) Cr(OH)2,Фторид хрома (II) CrF2,Хлорид хрома (II) CrCl2,Бромид хрома (II) CrBr2,Иодид хрома (II) CrI2,Сульфид хрома (II) CrS.Сульфат хрома (II) CrSO4,Оксид хрома (III) Cr2O3,Гидроксид хрома (III) Cr(OH)3,Фторид хрома (III) CrF3,Хлорид хрома (III) CrCl3,Бромид хрома (III) CrBr3,Иодид хрома (III) CrI3,Оксифторид хрома (III) CrOF,Сульфид хрома (III) Cr2S3,Сульфат хрома (III) Cr2(SO4)3,Оксид хрома (IV) CrO2,Фторид хрома (IV) CrF4,Хлорид хрома (IV) CrCl4,Оксид хрома (VI) CrO3.,Пероксид хрома (VI) CrO5,Хромат калия K2CrO4.Дихромат натрия Na2Cr2O7,Дихромат калия K2Cr2O7
Важнейшие соединения Mn: Оксид хрома (II) CrO,Гидроксид хрома (II) Cr(OH)2,Фторид хрома (II) CrF2,Хлорид хрома (II) CrCl2,Бромид хрома (II) CrBr2,Иодид хрома (II) CrI2,Сульфид хрома (II) CrS.Сульфат хрома (II) CrSO4,Оксид хрома (III) Cr2O3,Гидроксид хрома (III) Cr(OH)3,Фторид хрома (III) CrF3,Хлорид хрома (III) CrCl3,Бромид хрома (III) CrBr3,Иодид хрома (III) CrI3,Оксифторид хрома (III) CrOF,Сульфид хрома (III) Cr2S3,Сульфат хрома (III) Cr2(SO4)3,Оксид хрома (IV) CrO2,Фторид хрома (IV) CrF4,Хлорид хрома (IV) CrCl4,Оксид хрома (VI) CrO3.Пероксид хрома (VI) CrO5,Хромат калия K2CrO4,.Дихромат натрия Na2Cr2O7,Дихромат калия K2Cr2O7
|
|
|
Биологическая роль: Cr в организме содержится около 6г. Металлический хром нетоксичен,а соединения Cr(III) и Cr(VI) опасны для здоровья. Поддерживает нормальный уровень глюкозы в крови, усиливает действие инсулина, регулирует работу щитовидной железы, регулирует деятельность сердечной мышцы и кровеносных сосудов.
Mn в организме содержится около 12мг. Активирует или входит в состав многих ферментов,является катализатором некоторых реакций в организме человека,участвует в синтезе белка,регулирует функционирование мышц, развитие соединительной ткани, хрящей, скелета.
Зависимость свойств соединений.. В природе Cr находится в трехвалентном и шестивалентном состоянии. Гидроксид хрома (III) обладает амфотерными свойствами. Соединения трехвалентного хрома, как и двухвалентного, проявляют восстановительные свойства Сr2(SO4)з+КСlО3 + 10КОН = 2К2СrO4 + 3К2SО4 + КСl + 5Н2О. Соединения хрома (VI), как правило, кислородсодержащие комплексы хрома Для марганца характерны степени окисления +2, +3, +4, -1-6, +7. В растворах существует в виде катионов Мn2+ и Мn3+. В высших степенях окисления существует в анионной форме МnО4. Гидроксид марганца (II) обладает слабоосновными свойствами. В щелочной среде Мn2+ окисляется до МnО42-, а в кислой до МnО4. Перманганаты - сильные окислители
Качественные реакции с Cr:
1. Реакции с щелочами и с аммиаком.
Сг3++ 3 ОН- —- Сг(ОН)3 Сг3++ 3 NH3-H2O -> Сг(ОН)3| + 3 NH4+.Осадок Сг(ОН)3, растворяется как в щелочах, так и в кислотах:
Сг(ОН)3+ 3 ОН- ->• [Сг(ОН)6]3',
Сг(ОН)3+ 3 НС1 +3 Н2О — [Сг(Н2О)6]3++ 3 С1-.
Сг(ОН)3.+ 6 NH3-H2O — [Cr(NH3)6]3++ 3 ОН- + б Н2О
2. Реакции окисления катионов хрома (III) до хромат - ионов и дихромат — ионов.а) Окисление пероксидом водорода. Проводят обычно в щелочной среде при нагревании:
2 [Сг(ОН)6]3- + 3 Н2О2= 2 Сг О42-+ 2 ОН- + 8 Н2О б) Окисление персульфатом аммония. Проводят в кислой среде в присутствии катализатора - солей серебра (I) (AgNO3).
2 Сг3++ 3 S2O82- + 7 Н2О -> Сг2О72- + 6 SO42- + 14 Н+.
в) Окисление перманганатом калия КМпО4.
10 Сг3++ 6 МпО4-+ 11 Н2О -> 5 СьО72' + 6 Мп2++ 22 Н+.
3.Реакция образования надхромовой кислоты:
2СгО42-+ 2 Н+—> Сг2О72- + Н2О
Сг2О72- +4 Н2О + 2 Н+= 2 Н2СгО6 + 3Н2О
Качественные реакции Mn:1. Реакции с щелочами и аммиаком: Мп2++ 2 ОН-—+ Мп(ОН)2.
2 Мп(ОН)2+ 02 = 2 МпО(ОН)2
Мп(ОН), 2NH4С1 — Мп +2 NН3Н2О + 2 С1
2. Реакция окисления катионов Мп2до перманганат — ионов.
2 МпО4+ 10 С2О8+ 16 Н — 2Мп2++ 5 Сl2+ 8 Н20
а) Окисление висмугатом натрия в кислой среде.
2 Мп2++ 5 NаВiО3+ 14 Н — 2 Мп04+ 5 Вi3+ 5Nа + 7 Н2О
б). Окисление персульфатом аммония. Реакцию проводят в кислой среде в присутствии катализатора — солей серебра (Аg3) при нагревании:
2 Мп2 + 5 820i + 8 Н20 = 2 Мп04 + 10 $042 + 16 Н.
36. К d-блоку относятся 32 элемента периодической системы. D-элементы входят в 4-7 большие периоды. Относится к VIIIБ-группе. Всего 9 элементов: железо,кобальт,никель,рутений,родий,палладий,осмий,иридий,платина.
Электронная структура: электронная формула 1s2 2s2 2p6 3d6 4s2. Валентные электроны у атома железа находятся на последнем электронном слое (4s2) и предпоследнем (3d6). В химических реакциях железо может
отдавать эти электроны и проявлять степени окисления +2, +3 и, иногда, +6.
Общая характеристика: Образуют комплексные соединения с разнообразными лигандами. Переменная валентность,разнообразие степеней окисления. С увеличением атомного номера в группах Б металлические свойства уменьшаются,увеличиваются окислительные свойства,возрастает энергия ионизации.
Важнейшие соединения железа: Оксид железа (II) FeO. Гидроксид железа (II) Fe(OH)2.Фторид железа (II) FeF2Хлорид железа (II) FeCl2.Бромид железа (II) FeBr2.Иодид железа (II) FeI2.Сульфид железа (II) FeS.Сульфат железа (II) FeSO4.Карбонат железа (II) FeCO3.Оксид железа (III) Fe2O3.Оксид железа (II, III) Fe3O4.Гидроксид железа (III) Fe(OH)3. Фторид железа (III) FeF3. Хлорид железа (III) FeCl3.Бромид железа (III) FeBr3.Феррат калия K2FeO4.Пентакарбонил железа (VI) Fe(CO)5.
|
|
|
Биологическая роль: Является биогенным элементом, в организме содержится около 5г. Металлическое железо мало токсично,а соединения Fe(II), Fe(III) и Fe(VI) в больших количествах опасны для здоровья. Обеспечивает транспорт кислорода, электронов в окислительно-восстановительных реакциях организма.
Аналитические реакции катиона железа Fe2+
1.Реакции с щелочами и аммиаком: Fei++ 2 ОН- —- Fe(OH)
4 Fe(OH)2+О2+ 2 Н2О —> 4 Fe(OH)3
2. Реакция с гексацианоферратом (III) калия
4 Fe3++ 3 [Fe (CN)6]4- + XH2O — Fe4[Fe (CN)6]3-XH2O
Суммарно: 4Fe2++4[Fe-' (CN)6]3- + XH2O -♦ Fe111[Fe- (CN)6]3-XH2O +[Fe- (CN)6]4-
(CH3CNOH)2+ Fe2++ 2 NH4OH ->■ [Fe(C4H7N2O2)2] + NH3+ 2 H2O
Аналитические реакции катионов железа (III) Fe3+
1.Реакция с щелочами и аммиаком:Fe3++ 3 ОН' —> Fe(OH)3J.
2.Реакция с гексацианоферратом (II) калия
4 Fe3++ 3 [Fe (CN)6]4' + ХН2О — Fe4[Fe (CN)6]3-XH2O
3.Реакция с тиоционат — ионами при рН~3
[Fe(H2O)6]3++ nNCS- = [Fe (NCS)n(H2O)6.J3-n+ nH2O (где n=l,2,3,....6)
4.Реакция с сульфид - ионами (фармакопейная):2 Fe3++ 3 S2-Fe2S3
37. К p-блоку относят 30 элементов IIIА – VIIIА-групп периодической системы. Появляется первый электрон на p-орбитали. IVА-группу составляют углерод,кремний,германий,олово,свинец.
Электронная структура: общая электронная формула валентной оболочки атомов ns2np2 . В невозбужденном состоянии не спарены два p-электрона. Проявляют степень окисления +2. Но в возбужденном состоянии ns1np3 и все 4 электрона оказываются неспаренными.
Общая характеристика: В периодах слева направо радиусы атомов уменьшаются, энергия ионизации увеличивается, электроотрицательность увеличивается, окислительная активность и неметаллические свойства усиливаются. Сверху вниз радиус атома увеличивается, уменьшается энергия ионизации и окислительная активность, металлические свойства усиливаются.
Биологическая активность: из различных соединений углерода состоят все ткани организма, его соединения участвуют во всех биохимических процессах, при окислении соединений углерода образуется необходимая для организма энергия оксид углерода (IV) CO2, образующаяся в результате окисления соединений углерода, стимулирует дыхательный центр, регулирует значение рН крови.
|
|
|
Применение в медицине. Активированный уголь используется для выведения из организма различных токсинов. Графит — для лечения кожных заболеваний.
Аналитические реакции оксалат- иона С2О4. 1. Реакция с хлоридом бария
Ва2++ С2О42-= ВаС2О4(белый)
2. Реакция с хлоридом кальция
Са2++ С2О42- = СаС2О4(белый)
3.Реакция с перманганатом калия.
4 С2О42- + 2 МпО4' + 16 Н+->• 10 СО2+ 2 Мп2++ 8 Н2О
Аналитические реакции карбонат - иона СО32-. 1.Реакция с хлоридом бария.
Ва2++ СОз2- —> ВаСО3(белый мелкокристаллический)
2.Реакция с сульфатом магния (фармакопейная).
Mg2++ СОз2- ->MgCO3(белый)
3. Реакция с минеральными кислотами (фармакопейная).
СО32-+ 2 Н3О = Н2СО3+ 2Н2О
НСО3-+ Н3О+= Н2СО3+ 2Н2О
Н2СО3-- СО2+ Н2О
4.Реакция с гексацианоферратом (II) уранила.
2СО32- + (UО2)2[Fe(СN)6](коричневы)-> 2 UO2CO3(бесцветный) + [Fe(CN)6]4-
Аналитические реакции ацетат - иона CH3COO'. 1.Реакция с хлоридом железа (III) (фармакопейная).
3 СНзСООН + Fe -->• (CH3COO)3Fe + 3 Н+
2.Реакция с серной кислотой.Ацетат - ион в сильно кислой среде переходит в слабую уксусную кислоту, пары которой имеют характерный запах уксуса:СН3СОО- + Н+<- СН3СООН 3.Реакция образования уксусноэтилового эфира (фармакопейная).СН3СОО- + Н+-- СН3СООН СН3СООН + С2Н5ОН = СН3СООС2Н4+ Н2О
HCO3 nety
38.К p-блоку относят 30 элементов IIIА – VIIIА-групп периодической системы. Появляется первый электрон на p-орбитали. К VА группе относятся 5 элементов: азот, фосфор, мышьяк, сурьма, висмут.. Электронные структуры: атомы этих элементов имеют по 5 валентных электронов на s- и p-орбиталях внешнего энергетического уровня. Из них в невозбужденном состоянии атома неспарены три p-электрона. При возбуждении атомов происходит распаривание s-электрона и переход одного из них на d-подуровень.В соединениях элементы этой группы проявляют степени окисления +1,+2,+3,+4,+5,-3. Для азота характерны: +3,+5,-3,а также +2,+4. Для фосфора +5 и реже +3,-3. Степени окисления мышьяка, сурьмы и висмута: +3,+5,-3.
Общая характеристика: Начиная от азота,в сторону висмута растет устойчивость высших координационных чисел, неметаллические свойства ослабевают. Энергия ионизации и относительная электроотрицательность уменьшаются. Кислотность уменьшается. Соединения фосфора: Оксид фосфора (III) P4O6, Оксид фосфора (V) P4O10,
Фосфористая кислота H3PO3, где соли фосфористой кислоты — фосфиты. K3PO3(фосфит калия) или Mg3(PO3)2(фосфит магния)
Фосфорная кислота (ортофосфорная кислота) H3PO4,Фосфорная кислота образует три ряда солей:
а) K3PO4, Ca3(PO4)2- фосфаты;
б) K2HPO4, CaHPO4- гидрофосфаты;
в) KH2PO4, Ca(H2PO4)2- дигидрофосфаты.
Фосфорноватая кислота (гипофосфорная кислота) H4P2O6.
Фосфорноватистая кислота (гипофосфористая кислота) H3PO2. Гипофосфиты - соли фосфорноватистой кислоты(Ba(H2PO2)2)
Фосфин PH3(соли фосфония Ph4cl). При взаимодействии фосфора с металлами образуются соли - фосфиды. Например, Ca3P2(фосфид кальция), Mg3P2(фосфид магния).
Применение в медицине соединений фосфора, их биологическая роль. Фосфор относится к структурным макроэлементам, его содержание в организме взрослого человека составляет около 700 г. Фосфор входит в состав многих веществ организма,в костях фосфор выполняет структурную функцию,остатки фосфорной кислоты входят в состав нуклеиновых кислот и нуклеотидов – важнейшие аккумуляторы и переносчики энергии,остатки фосфорной кислоты входят в состав буферной системы крови, регулируя ее значение рН. Терапевтическое применение препаратов фосфора основано на том, что в малых дозах они усиливают рост и развитие костной ткани (в растущем организме), стимулируют кроветворение, обладают способностью тормозить окислительные процессы в организме и принимают участие в обмене веществ нервной и мышечной ткани. Аналитические реакции. 1)Реакция с хлоридом бария.:
HPO42-+Ba2+→BaHPO4,2 PO43-+ 3 Ba2+→ Ba3(PO4)2
2)Реакция с молибденовой жидкостью, раствор молибдата аммония (NH4)2MoO4в азотной кислоте.
PO43-+ 3NH4++ 12MoO42-+ 24H+→ (NH4)3[P(Mo3O10)4] + 12H2O
39.К p-блоку относят 30 элементов IIIА – VIIIА-групп периодической системы. Появляется первый электрон на p-орбитали. К VIА группе относятся 5 элементов: кислород,сера,селен,теллур,полоний. Общее название элементов — халькогены.
Электронные структуры: атомы этих элементов имеют по 6 валентных электронов на s- и p-орбиталях внешнего энергетического уровня. Из них две p-орбитали заполнены наполовину. Атом кислорода отличается от других атомов отсутствием низколежащего d-подуровня,поэтому он способен образовывать только 2 связи с атомами других элементов. Атомы серы и других элементов способны образовывать не только 2, но и 4 и 6 связей с атомами других элементов.
Общая характеристика: С увеличением порядкового номера элементов VIА-группы окислительная активность понижается,а восстановительная активность увеличивается,вследствии неметаллические свойства ослабевают. Координационные числа возрастают. В нормальных условиях водородные соединения элементов VIА-группы,за исключением воды, - газы с очень неприятными запахами. Термодинамическая стабильность уменьшается.
Соединения кислорода: ОКСИДЫ: нормальные (MgO),основные (СаО), кислотные (SO3), амфотерные (ZnO), нейтральные (NO) ПЕРОКСИДЫ: H2O2, ГИДРОКСИДЫ.
ОЗОН О3, аллотропная форма кислорода. Газ синего цвета, в жидком состоянии темно-синий, в твердом-сине-фиолетовый.
Биологическая роль: Кислород относится к элементам-органогенам. Его содержание составляет до 40 кг у взрослого. Основной функцией кислорода является его участие как окислителя в окислительно-восстановительных реакциях в организме. Благодаря наличию кислорода, организмы всех животных способны утилизировать различные вещества с извлечением определенной энергии «сгорания» для собственных нужд.
Применение в медицине: кислород вводится в лечебных целях в дыхательные пути(оксигенотерапия). используется для обогащения дыхательных газовых смесей в наркозной аппаратуре, при нарушении дыхания, для купирования приступа бронхиальной астмы, для лечения патологии желудочно-кишечного тракта в виде кислородных коктейлей. В условиях стационара применяются кислородные ингаляторы. Озон используется для стерилизации изделий медицинского назначения, для сильного дезинфицирующего средства.
40.К p-блоку относят 30 элементов IIIА – VIIIА-групп периодической системы. Появляется первый электрон на p-орбитали. К VIА группе относятся 5 элементов: кислород,сера,селен,теллур,полоний. Общее название элементов — халькогены.
Электронные структуры: атомы этих элементов имеют по 6 валентных электронов на s- и p-орбиталях внешнего энергетического уровня. Из них две p-орбитали заполнены наполовину. Атом кислорода отличается от других атомов отсутствием низколежащего d-подуровня,поэтому он способен образовывать только 2 связи с атомами других элементов. Атомы серы и других элементов способны образовывать не только 2, но и 4 и 6 связей с атомами других элементов.
Общая характеристика: С увеличением порядкового номера элементов VIА-группы окислительная активность понижается,а восстановительная активность увеличивается,вследствии неметаллические свойства ослабевают. Координационные числа возрастают. В нормальных условиях водородные соединения элементов VIА-группы,за исключением воды, - газы с очень неприятными запахами. Термодинамическая стабильность уменьшается.
Соединения серы: SO2 — сернистый ангидрид, SO3 — серный ангидрид, H2SO4 – серная кислота, H2S — сероводород, сульфиды: Na2S,CaS,Ag2S.
Биологическая роль: Сера является структурным макроэлементом, ее содержание в организме взрослого человека составляет около 140 г. Ее биологическая роль состоит в том, что она входит в структуру таких аминокислот, как цистеин и метионин, которые и выполняют в животных организмах (в том числе у человека), ряд незаменимых функций: является компонентом многих ферментов, гормонов, является компонентом таких активных веществ, как гистамин, витамин, обеспечивает передачу энергии в клетке, участвует в переносе метильных групп. Применение в медицине: серу используют при болезнях кожи(чесотка,экзема), как слабительное средство, выводят метаболиты из организма.
Аналитические реакции: SO4
1.Реакция с катионами бария (фармакопейная).
BaSO4+ H2SO4->Ba(HSO4)2
2.Реакция с катионами свинца.
PbSO4+ 4 NaOH -- Na2[Pb(OH)4] + Na2SO4
SCN-
1. Реакция с нитратом серебра.
AgSCN + 2 NH3— [Ag(NH3)2]++ SCN-
2.Реакция с солями кобальта (II).4 SCN' + Со2+<-> [Co(SCN)4]2-
41. К p-блоку относят 30 элементов IIIА – VIIIА-групп периодической системы. Появляется первый электрон на p-орбитали. В VIIА-группу входят 5 элементов, называемых галогенами: фтор, хлор, бром, йод, астат.
Электронные структуры: На валентных орбиталях атомов галогенов находится по семь электронов — 2 на s- и 5 на p-орбиталях. Общая электронная формула валентной оболочки ns2np5,где n-номер периода. До завершения оболочки благородных электронов газов недостает одного электрона,поэтому галогены являются сильными окислителями.
Общая характеристика: С увеличением порядкового номера увеличивается радиус атома, энергия ионизации, окислительная активность и электроотрицательность уменьшаются, окислительные свойства уменьшаются,а металлические увеличиваются. Увеличивается устойчивость кислородных соединений. Фтор является наиболее сильным окислителем из группы.
Галогены — вещества общей формулы Г2, т. е. Состоят из двухатомных молекул: F2,Cl2,Br2,I2,At2. Элементные галогены являются сильными окислителями и вступают во взаимодействие почти со всеми простыми веществами — металлами и неметаллами, образуя галогениды(NaCl,Ca(Cl)2,BeF2,MgF2,NaBr,KBr,NaJ,AgJ). Водородгалогениды - соединения галогенов,в которых они проявляют степень окисления (-1): HF-HCl-HBr-HJ, они являются кислотами.
Биологическая роль: Фтор-содержится в организме около 2,6г. Регулирует активность ферментов,участвует в формировании костной ткани,формировании эмали. Хлор-содержится в организме около 50-60г. Вместе с ионами калия и натрия поддерживает осмотическое давление,регулирует pH крови. Бром-содержится в организме около 200мг. Усиливает ряд тормозных процессов в центральной нервной системе. Йод-содержится в организме около 20-30мг. Основная биологическая роль-синтез гормонов щитовидной железы,стимулирует рост,повышает артериальное давление.
Аналитические реакции: Cl-
1.Реакция с нитратом натрия
С1- + Ag+ —> AgCl.
AgCl + NaNo3 = AgNo3 + NaCl
2.Реакция с сильными окислителями.
Mn(OH)2 + Cl2 + 2 KOH = MnO2 + 2 KCl + 2 H2О
Аналитические реакции бромид - иона Вг
1.Реакция с AgNO3 (фармакопейная).
Br- + Ag+ —► AgBr (желтоватый)
AgBr + 2 S2O32- -> [Ag(S2O3)2]3- + Br-
2.Реакция с сильными окислителями (фармакопейная).
2Cr(Oh)3 + 3Br2 + 10NaOh = 2Na2CrO4 + 6NaBr + 8H2O
Аналитические реакции иодид — иона l-
1.Реакция с металлами.
I-+Ag+=AgI
2.Реакция с окислителями (фармакопейная - с NaNO2 и FeCb, в качестве окислителей).
J2 + 10HNO3 = 2HJO3 + 10NO2 + 4H2O
4.Реакция с солями свинца.
21- + Pb2+= Рb12
Рb12 + 2 I -> [Рb14]2-
42 Титриметрический анализ - методы количественного анализа в аналитической и фармацевтической химии, основанные на измерении объёма раствора реактива известной концентрации, расходуемого для реакции с определяемым веществом.
Титриметрический анализ использует различные типы химических реакций:
нейтрализации (кислотно-основное титрование) — нейтрализация — это реакции с изменением pH растворов.
окисления-восстановления(перманганатометрия, иодометрия, хроматометрия) — реакции, которые происходят с изменением окислительно-восстановительных потенциалов в системе титрования. осаждения (аргентометрия) — реакции, протекающие с образованием малорастворимого соединения, при этом изменяются концентрации осаждаемых ионов в растворе. комплексообразования (комплексонометрия) — реакции, основанные на образовании прочных комплексных соединений ионов металлов (всех, кроме одновалентных) с комплексоном III (двунатриевой солью этилендиаминтетрауксусной кислоты), при этом изменяются концентрации ионов металлов в титруемом растворе.
Титрование — процесс определения титра исследуемого вещества. Титрование производят с помощью бюретки, заполненной титрантом до нулевой отметки. Титровать, начиная от других отметок, не рекомендуется, так как шкала бюретки может быть неравномерной. Заполнение бюреток рабочим раствором производят через воронку или с помощью специальных приспособлений, если бюретка полуавтоматическая. Конечную точку титрования (точку эквивалентности) определяют индикаторами или физико химическими методами. Эквивалент вещества - реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалента катионы водорода в ионообменных реакциях или электрону в ОВР. Фактор эквивалентности fэкв (Х) – число, обозначающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или 1 электрону в данной ОВР.
fэкв (Х)=1/Z, Z – основность кислоты или кислотность основания; или число электронов, присоединяемых или теряемых частицей в дано ОВР
Молярная масса эквивалента вещества Х – произведение фактора эквивалентности на молярную массу вещества Х.
М(1/Z Х) = 1/Z. М(Х) (г/моль)
Молярная концентрация с –отношение количества вещества (в молях), содержащегося в растворе, к объему раствора. Молярная концентрация эквивалентов (нормальная концентрация) – это отношение количества вещества эквивалентов (моль) к объему раствора (л). Единица измерения нормальной концентрации моль/л.. Закон эквивалентов:все вещества реагируют в эквивалентных отношениях. Формула, выражающая Закон эквивалентов: m1Э2=m2Э1
Точка эквивалентности (в титриметрическом анализе) — теоретическая точка, соответствующая 100%-ному оттитровыванию определяемого компонента. Способы фиксирования 1)с помощью индикаторов2)потенциометрия – совокупность физико-химических методов исследования, в основе которых лежит измерение электродвижущей силы цепей, состоящих из индикаторного электрода и электрода сравнения3) с помощью рН – метров4)проводимость5)изменение цвета 6)осаждение
43.ПРОВЕРИТЬ Кислотно-основное титрование — титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации:
Н3O+ + ОН− = 2Н2О
Титрование раствором щелочи называется алкалиметрией, а титрование раствором кислоты — ацидиметрией.
В кислотно-основном титровании в качестве индикаторного обычно используют стеклянный электрод. Потенциометрический метод позволяет провести количественное определение компонентов в смеси кислот, если константы диссоциации различаются не менее чем на три порядка.
При количественном определении кислот — ацидиметрия — рабочим раствором является раствор щелочи NaOH или КОН. При количественном определении щелочи — алкалиметрия —раствор сильной кислоты (обычно НСl или H2SO4).
Если титровать раствор любой кислоты раствором щелочи, происходит связывание ионов Н+ кислоты ионами ОН- и концентрация ионов Н+ постепенно уменьшается, а рН раствора возрастает. При определенном значении рН достигается точка эквивалентности и титрование должно быть закончено. При титровании раствора щелочи раствором кислоты связываются ионы ОН~, концентрация их в растворе уменьшается, а концентрация ионов Н+ увеличивается и рН раствора уменьшается. Величина рН зависит от природы реагирующей кислоты и основания.
Форма теоретических кривых может быть близка к форме экспериментальных кривых. Часто, экспериментальные кривые смещены относительно теоретических, поскольку при построении последних, обычно, оперируют концентрациями, а не активностями. Изучение теоретических кривых показывает, что небольшая погрешность потенциометрического определения рН не имеет значения при определении конечной точки титрования.
Потенциометрическое кислотно-основное титрование особенно удобно при анализе смесей кислот или многоосновных кислот (оснований), поскольку оно часто позволяет достичь разделения конечных точек титрования. Из кривых потенциометрического титрования можно также определить приближенные значения констант диссоциации реагирующих веществ. Теоретически эту величину можно рассчитать из любой точки на кривой титрования, практически же ее легче найти из значения рН в точке полунейтрализации. Например, при титровании слабой кислоты НА в средней точке можно предположить, что
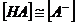
и поэтому 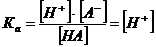
рКа = рН.
Константы диссоциации, определенные этим способом, отличаются от констант, приводимых в таблицах, поскольку последние включают активности, в то время как первые – концентрации:
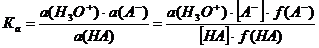
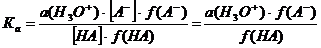
Затем после приведения к р-функции и преобразования получаем:
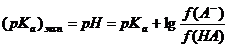
Таким образом, истинное значение рКа будет отличаться от экспериментального на величину логарифма отношения коэффициентов активности.
Из одного-единственного потенциометрического титрования можно получить и величину эквивалентной массы, и приблизительное значение константы диссоциации очищенной пробы неизвестной кислоты; часто эта информация достаточна для идентификации кислоты.
44.Оксидиметрия — титриметрические методы в аналитической химии, основанные на реакциях окисления-восстановления. В процессе титрования изменяется окислительно-восстановительный потенциал системы, вблизи точки эквивалентности наблюдается резкое изменение потенциала. Оксидиметрию классифицируют в зависимости от применяемого в данной реакции раствора вещества — окислителя или восстановителя. К оксидиметрии относятся перманганатометрия, цериметрия, хроматометрия, иодометрия и др.
Нормальную концентрацию определяемого окислителя вычисляют по формуле: 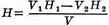
Оксидиметрия — совокупность методов объемного химического анализа, в основе которых лежат окислительно-восстановительные реакции. В результате этих реакций одни вещества (восстановители) окисляются, а другие (окислители) восстанавливаются; при этом окисляющееся вещество теряет электроны, а восстанавливающееся их приобретает. Например, при взаимодействии трехвалентных ионов железа с ионами йода: 2Fe3++2J-=2Fe2++J2.
Ионы йода теряют электроны и окисляются до свободного йода, а ионы трехвалентного железа, присоединяя электроны, восстанавливаются до ионов двухвалентного железа. Сущность оксидиметрии состоит в измерении посредством титрования объема рабочего раствора данного окислителя (восстановителя), который необходимо затратить на полное окисление (или восстановление) исследуемого вещества, содержащегося в данном объеме его раствора, взятого для титрования. Из многочисленных методов оксидиметрии в санитарно-гигиенических, клинических, фармацевтических и биохимических лабораториях наиболее широко применяют перманганатометрию и йодометрию.
ПЕРМАНГАНАТОМЕТРИЯ
Перманганатометрическое титрование основано на реакциях окисления восстановителей ионом перманганата чаще всего в кислой среде в присутствии серной кислоты. Восстановление MnO4- до Mn2+ протекает с присоединением пяти электронов по реакции:
MnO4- +8H++5e →Mn2++ 4H2O;
E0(MnO4-/Mn2+) = +1,51В.
В нейтральной или слабо щелочной среде восстановление перманганат-ионов до МnO2 протекает по уравнению:
MnO4-+ 2H2O + 3e →MnO2 + 4OH-
E0(MnO4-/MnO2) = +0,59В.
Индикатором в перманганатометрии служит титрант, так как перманганат-ионы окрашивают бесцветные растворы в слабо-розовый цвет. В количественном анализе перманганатометрически определяют:
1 ) прямым титрованием — восстановители: железо (II), щавелевую кислоту и ее соли, альдегиды, фармакопейные препараты, такие как раствор пероксида водорода, железо восстановленное и др.;
2) обратным титрованием — окислители: железо (III),нитраты, дихромат.;
3) методом замещения или обратного титрования определяют катионы Ca2+, Ba2+, Pb2+
Для количественной характеристики окислительно - восстановительных процессов используют, в частности, молярную массу эквивалентов окислителя и восстановителя определяемую по формуле - она равна частному от деления молярной массы окислителя или восстановителя на число электронов, принятых или отданных одной структурной единицей вещества:
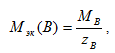
45.Оксидиметрия — титриметрические методы в аналитической химии, основанные на реакциях окисления-восстановления. В процессе титрования изменяется окислительно-восстановительный потенциал системы, вблизи точки эквивалентности наблюдается резкое изменение потенциала. Оксидиметрию классифицируют в зависимости от применяемого в данной реакции раствора вещества — окислителя или восстановителя. К оксидиметрии относятся перманганатометрия, цериметрия, хроматометрия, иодометрия и др.
Оксидиметрия — совокупность методов объемного химического анализа, в основе которых лежат окислительно-восстановительные реакции. В результате этих реакций одни вещества (восстановители) окисляются, а другие (окислители) восстанавливаются; при этом окисляющееся вещество теряет электроны, а восстанавливающееся их приобретает. Например, при взаимодействии трехвалентных ионов железа с ионами йода: 2Fe3++2J-=2Fe2++J2.
Ионы йода теряют электроны и окисляются до свободного йода, а ионы трехвалентного железа, присоединяя электроны, восстанавливаются до ионов двухвалентного железа. Сущность оксидиметрии состоит в измерении посредством титрования объема рабочего раствора данного окислителя (восстановителя), который необходимо затратить на полное окисление (или восстановление) исследуемого вещества, содержащегося в данном объеме его раствора, взятого для титрования. Из многочисленных методов оксидиметрии в санитарно-гигиенических, клинических, фармацевтических и биохимических лабораториях наиболее широко применяют перманганатометрию и йодометрию.
В йодометрии применяют два рабочих раствора: раствор йода — J2 и раствор тиосульфата (гипосульфита) натрия — Na2S2O3, концентрации которых точно установлены и обычно близки к 0,05 н. Йодометрическое определение восстановителей производят методом обратного титрования. Для этого к данному раствору восстановителя приливают точно измеренный объем (взятый в избытке) рабочего раствора йода. Часть йода, не вошедшую в реакцию с определяемым восстановителем, титруют рабочим раствором тиосульфата натрия. Йодометрическое определение окислителей производят, добавляя к данному объему раствора окислителя избыток раствора йодистого калия— KJ. При этом ионы йода — J - окисляются до свободного йода — J2, который титруется тиосульфатом натрия. Таким образом, йодометрическое определение как окислителей, так и восстановителей сводится к титрованию свободного йода рабочим раствором тиосульфата натрия. Для определения конца титрования (точки эквивалентности) в качестве индикатора используют раствор крахмала. При наличии свободного йода крахмал окрашивается в синий цвет, титрование ведут до исчезновения синей окраски раствора.
В основе йодометрического метода лежит полуреакция:
I2+ 2e →2I-,
E0(I2/2I-) = + 0,54B.
Метод применим как для определения восстановителей, так и
окислителей. Например, определение сульфит-иона идет по реакции:
SO32-+ I2+ H2O →SO42-+ 2I-+ 2H+
 2015-01-30
2015-01-30 1868
1868







