Если систему, состоящую из двух электродов и раствора электролита, включить в цепь постоянного электрического тока, то у электродов начинают протекать реакции окисления-восстановления – у анода восстановитель отдает электроны (в сеть) и окисляется; у катода окислитель принимает электроны (из сети) и восстанавливается.
Процесс окисления-восстановления, который осуществляется под действием постоянного электрического тока, называется электролизом.
Химические реакции, протекающие при электролизе, зависят от растворенного электролита, растворителя и материала электродов.
На катоде в первую очередь идут процессы, характеризуемые наиболее положительным потенциалом, т.е. в первую очередь реагируют сильные окислители. На аноде в первую очередь идут процессы, характеризуемые наиболее положительным потенциалом, т.е. в первую очередь идут процессы, в которых реагируют сильные восстановители.
Если потенциалы двух или нескольких электродных реакций равны, то эти реакции протекают на электроде одновременно. При этом прошедшее через электрод электричество расходуется на все эти реакции. Доля количества электричества, расходуемая на превращение одного из веществ (Bј), называется выходом по току этого вещества.
Bј(%) = Qј ∙100/Q,
где Qј – количество электричества, израсходованное на превращение ј вещества.
Q – общее количество электричества, прошедшего через раствор.
Теоретическое соотношение между количеством прошедшего электричества и количеством вещества, окисленного или восстановленного на электроде, определяется законом Фарадея, согласно которому при прохождении через электрод одного Фарадея электричества (F = 96500Кл = 26,8А∙ч) на нем окисляется или восстанавливается 1 моль эквивалентов вещества.
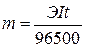 ,
,
где m – масса вещества, окисленного или восстановленного на электроде, г
Э – величина эквивалентной массы вещества,
I – сила тока в амперах (А),
t – время электролиза, сек.
 2015-01-07
2015-01-07 357
357








