Опыт 1. Определение ЭДС элемента.
Соберите следующую установку:
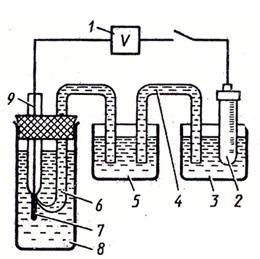
1. катодный вольтметр
2. электрод сравнения
3. сосуд с электродом сравнения
4. соединительный электролитический ключ
5. промежуточный сосуд
6. электрический ключ с капилляром, прижимаемым к электроду
7. изучаемый электрод
8. сосуд для изучаемого электрода.
I. Для этого приготовьте две электродные системы, состоящие из металлов, погруженных в растворы собственных солей. Конкретные металлы (Zn, Cd, Fe, Cu, Pb, Sn).
Сосуды для растворов предварительно вымойте проточной водой под краном, ополосните раствором соли соответствующего металла и залейте этот раствор на 2/3 их объема. Металлические стержни или пластинки тщательно зачистите наждачной бумагой, промойте проточной водой под краном и погрузите сосуды с раствором соли.
Включите ключом 9 измерительную цепь схемы. Запишите показания катодного вольтметра 1.
1. Запишите уравнения электродных и токообразующих реакций.
2. Рассчитайте ЭДС и сравните ее с экспериментальным значением.
3. Рассчитайте стандартную ЭДС элемента.
II.ьно залла и залейте этот раствор на 2/3 их объема.сните ратсвором ры собственных солей. Измерьте ЭДС гальванического элемента, составленного из двух полуэлементов по схеме: Cu | CuSO4 || FeSO4 | Fe.
С этой целью замените в предыдущем опыте электрод сравнения железным полуэлементом. Сравните опытные данные с теоретически вычисленной ЭДС.
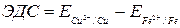
В составленном гальваническом элементе протекает химическая реакция
Fe0 + Cu2+ → Fe2+ + Cu0
На электроде из железа, который погружен в раствор соли, идет реакция окисления атомов железа в ионы (растворение железа).
Fe0 → Fe2+ + 2e.
На медном электроде, погруженном в раствор медного купороса, происходит восстановление ионов металла. Медь – положительный полюс элемента, принимает электроны от железного электрода
(+) Cu | CuSO4 || FeSO4 | Fe (-).
Опыт 2. Электролиз
а) Налейте в электролизер раствор сульфата меди. Опустите в него графитовые электроды и пропустите через раствор электрический ток; опыт проводите несколько минут. Что наблюдается на катоде? Напишите уравнения катодного и анодного процессов. Какой газ выделится на аноде? Поменяйте местами электроды в электролизере и снова пропускайте электрический ток. Что происходит с медью на аноде и какое вещество выделяется на катоде? Напишите уравнения процессов, протекающих при электролизе CuSO4 с медным анодом.
Явление электролиза используется для определения полюсов. Убедитесь в этом на опыте.
б) Возьмите полоску фильтровальной бумаги, положите на предметное стекло, смочите ее раствором NaCl и добавьте 1 - 2 капли фенолфталеина. Концы проводов от медного и железного электродов гальванического элемента плотно приложите к смоченной фильтровальной бумаге на некотором расстоянии друг от друга. У какого полюса появилось красное окрашивание? Объясните химические процессы, протекающие у электродов, написав уравнения реакции.
Опыт 3. Получение цинка электролизом.
На примере катодного осаждения цинка определяют выход цинка по току и расход энергии на единицу массы цинка.
В лабораторный стакан налейте раствор состава: сульфат цинка 1моль/л, серная кислота 1моль/л.
В стакан опустите два графитовых электрода, укрепленных на крышке-диэлектрике на расстоянии 0,5 – 1 см друг от друга. Предварительно определите массу катода. Подключите электролизер к источнику постоянного тока. Электролиз проводите при плотности тока на электродах 500 А/м2 в течении 20-30 мин. В процессе электролиза измерьте напряжение на электролизере. Отключив электролизер, удалите электрод из раствора, осушите его фильтровальной бумагой и определите его массу.
Используя электродные потенциалы, приведите обоснование электродных процессов и запишите их уравнения. Определите количество осажденного металла, количество электричества и соответствующую ему теоретическую массу выделяющегося цинка (m2). Рассчитайте выход цинка по току.
Результаты опыта сведите в таблицу:
| Ток, А | Время электролиза, ч | Кол-во электричества, А∙ч | Масса катода, г | Выход цинка по току, % | Напряжение на электролизере, В | Расход энергии, Вт∙ч/кг. | |||
| До опыта | После опыта | изменение | |||||||
| m1 | m2 | ||||||||
Определите расход энергии на выделение 1 кг цинка.
Расход энергии на (вычисление) электрохимическое получение 1кг металла Wm вычисляется по уравнению
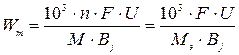 ,
,
где F – постоянная Фарадея (96500К/моль = 26,8 А∙ч/моль);
U – напряжение на электролизере, В;
Bј – выход металла по току, %;
МЭ = М/n – молярная масса эквивалента металла, г/моль;
М – молярная масса металла, г/моль;
n – изменение степени окисления металла или число электронов, принимаемых ионом металла при электроосаждении.
На основании анализа уравнения укажите пути снижения расхода энергии на получение 1 кг цинка.
Вопросы и задачи.
1. Как устроен гальванический элемент?
2. Как устроен стандартный водородный электрод?
3. Какие факторы влияют на потенциал металлического электрода?
4. Как измерить ЭДС гальванического элемента?
5. Что такое электролиз?
6. Какие процессы протекают у катода и анода при электролизе?
7. Чем определяется, какой из возможных процессов окисления-восстановления будет протекать в первую очередь?
8. В чем отличие процессов электролиза с растворимым и нерастворимым анодом?
9. Рассчитайте стандартную ЭДС гальванического элемента Pb | Pb2+ || Zn2+ | Zn по известным значениям стандартных потенциалов электродов.
10. Определите ЭДС гальванического элемента, состоящего из цинка, погруженного в 0,1 М раствор ZnSO4, и никеля, погруженного в 0,5 М раствор NiSO4, приняв, что электролиты полностью диссоциированы.
11. Рассчитайте ток в цепи и массу вещества, которое подверглось растворению при электролизе водного раствора сульфата калия с растворенным анодом, если на катоде выделилось 0,224 л водорода, измеренного при н.у. Время электролиза 1 ч.
Работа № 15.
 2015-01-07
2015-01-07 691
691








