Цель работы - изучение свойств элементов III - VII групп главных подгрупп и некоторых их соединений.
Опыты выполняются полумикрометодом.
В главных подгруппах III -VII групп периодической системы элементов расположены р-элементы (кроме водорода, относящегося к s-элементам), среди которых в свободном состоянии есть металлы и неметаллы.
В периодах слева направо в атомах заполняется р - подуровень от р1 до р5. Валентными являются не только р - электроны, но и s - электроны внешнего уровня. Их сумма соответствует номеру группы, в которой расположен элемент, и высшей степени окисления. Исключение составляют кислород и фтор, максимальная степень окисления которых -2 и -1 соответственно.
С увеличением числа электронов на внешнем уровне атомов уменьшается восстановительная способность атомов и усиливается их окислительная активность (увеличивается ионизационный потенциал, сродство к электрону, электроотрицательность).
В подгруппах сверху вниз у р - элементов заметно усиливаются восстановительные свойства.
Оксиды и гидроксиды неметаллов проявляют кислотные свойства. Свойства оксидов и гидроксидов металлов связаны с валентным состоянием металла: с ростом валентности металла усиливаются кислотные свойства.
Например, оксид свинца РbО - амфотерный оксид с преобладанием основных свойств, а диоксид свинца РbO2 - амфотерный оксид с преобладанием кислотных свойств.
Окислительно-восстановительные свойства соединений рассматриваемых элементов также связаны с валентным состоянием элемента: чем выше валентность элемента, тем более окислительными свойствами обладает его соединение.
Например, соединение серы (IV) - сернистая кислота. H2SO3 - хороший восстановитель; соединение серы (VI) - серная кислота H2SO4 (концентрированная) - сильнейший окислитель.
Опыт 1. Ортоборная кислота, ее получение и свойства.
а) Получение ортоборной кислоты из тетрабората натрия (буры).
В пробирку с 5 - 6 каплями горячего насыщенного раствора буры Na2B4О7 добавьте 2 - 3 капли концентрированной серной кислоты. Отметьте выпадение кристаллов ортоборной кислоты.
Напишите уравнение реакции получения Н3ВО3, учитывая, что в реакции участвует вода.
б) Разложение ортоборной кислоты.
Внесите в тигель немного (на кончике микрошпателя) ортоборной кислоты и нагрейте его через асбестовую сетку на электрической плитке или горелке. Над тиглем подержите колбу с холодной водой. Почему на холодных стенках колбы появились капли воды? Перенесите тигель тигельными щипцами на фарфоровый треугольник, положенный на кольцо штатива, и нагрейте его более сильно до прекращения выделения паров воды и образования стекловидной массы - борного ангидрида. Напишите уравнение реакции.
Опыт 2. Получение диоксида углерода и растворение его в воде.
Соберите прибор, как указано на рис. 5.
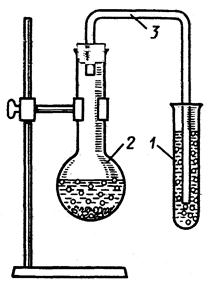
Рис.5. Прибор для получения газа и исследования взаимодействия его с раствором:
1- газоприемник; 2 – микроколба; 3 - газоотводная трубка.
Микроколбу 2 укрепите вертикально в штативе, положите в нее 3 - 4 маленьких кусочка мрамора, внесите 5 - 6 капель воды и 10 - 12 капель концентрированной соляной кислоты. Быстро закройте колбу пробкой с газоотводной трубкой 3, конец которой опустите в приготовленную заранее пробирку 1 с нейтральным раствором лакмуса. Отметьте изменение окраски лакмуса.
Напишите уравнение реакции получения диоксида углерода и растворение его в воде.
Опыт 3. Соли угольной кислоты.
а) Получение карбоната и гидрокарбоната кальция.
В коническую пробирку до половины ее объема налейте известковой воды. Приготовьте прибор для получения диоксида углерода (см. рис. 5). Выделяющийся диоксид углерода пропускайте через раствор известковой воды до выпадения осадка карбоната кальция. Продолжайте пропускать диоксид углерода до получения прозрачного раствора - образования растворимого гидрокарбоната кальция. Полученный раствор слегка нагрейте. Наблюдайте выпадение осадка карбоната кальция.
Напишите уравнения всех происходящих реакций.
б) Получение малорастворимых карбонатов бария и стронция. В две пробирки внесите по 4 - 6 капель раствора карбоната натрия и добавьте по 4 - 6 капель: в одну - раствора соли бария, в другую - стронция. Отметьте выпадение осадков и их цвет.
К осадкам карбоната бария и стронция добавьте по нескольку капель 2 М раствора уксусной кислоты. Наблюдайте растворение осадков.
Напишите уравнения всех происходящих реакций.
Опыт 4. Получение кремниевой кислоты.
В пробирку с раствором силиката натрия пропустите ток диоксида углерода (см. рис. 5). Наблюдайте образование осадка кремниевой кислоты. Напишите уравнение реакции.
Опыт 5. Получение свинца из его соединений.
Налейте в две пробирки по 5 - 6 капель раствора соли свинца и опустите в одну пластинку цинка, во вторую - хорошо очищенную пластинку алюминия. Отметьте появление кристаллов свинца на поверхности металлов.
Напишите уравнения соответствующих реакций.
Опыт 6. Отношение свинца к разбавленным кислотам.
В три цилиндрические пробирки положите по кусочку свинца и прилейте по 5 - 7 капель 2 М растворов кислот: в одну - соляной, во вторую - серной, в третью - азотной. Что наблюдается? Нагрейте пробирки на маленьком пламени горелки. Во всех ли пробирках идет реакция? По охлаждении растворов, добавьте к ним по 2 - 3 капли раствора иодида калия — реактива на ион свинца Рb2+. В какой из пробирок выпал желтый осадок иодида свинца?
На основании опыта сделайте вывод, в какой кислоте растворяется свинец. Какой газ при этом выделяется? Напишите уравнения реакций растворения свинца в кислоте и получения иодида свинца.
Опыт 7. Восстановительные свойства аммиака.
В пробирку внесите 3 - 4 капли перманганата калия и 3 - 5 капель раствора аммиака (с массовой долей NH3 25 %). Смесь слегка подогрейте. Что произошло с окраской раствора?
Напишите уравнение соответствующей реакции, учитывая, что аммиак окисляется до свободного азота, а осадок представляет собой диоксид марганца МnO2.
Опыт 8. Реакция обнаружения иона аммония в растворе.
Очень чувствительным реактивом на ион NH4+ является реактив Несслера. Он представляет собой щелочной раствор комплексного соединения ртути K2[HgI4] и образует с ионом аммония красно-бурый осадок состава NHg2I · Н2О.
В пробирку внесите 4 - 5 капель реактива Несслера и одну каплю раствора соли аммония. Наблюдайте образование красно-бурого осадка.
Опыт 9. Окислительные свойства азотной кислоты.
а) Взаимодействие разбавленной азотной кислоты с медью и оловом.
(Опыт проводить под тягой!) В две пробирки внесите по 3 - 4 капли разбавленной азотной кислоты (плотность 1,12 г/см3). В одну из пробирок опустите кусочек медной стружки, в другую - кусочек олова. В обоих случаях реакция идет с образованием главным образом бесцветного газа NO и нитратов олова (II) и меди (II).
Напишите уравнения реакции взаимодействия разбавленной азотной кислоты с оловом и медью.
б) Взаимодействие концентрированной азотной кислоты с медью и оловом. В две пробирки поместите по маленькому кусочку меди и олова. Прибавьте к ним по 3 - 5 капель концентрированной азотной кислоты. Осторожно подогрейте обе пробирки.
Отметьте свои наблюдения и напишите соответствующие уравнения реакций, считая, что при нагревании в обоих случаях азотная кислота восстанавливается до NО2.
Опыт 10. Получение сульфидов и изучение их свойств.
В четыре пробирки внесите по 3 - 5 капель растворов солей: кальция, кадмия, марганца (II) и свинца (II). К каждому раствору добавьте по 2 - 3 капли раствора сульфида аммония (или натрия). Отметьте свои наблюдения, указав цвет осадков. К осадкам прибавьте по 3 - 5 капель раствора азотной кислоты.
Напишите уравнения реакций получения сульфидов и растворения их в кислоте. Какие сульфиды не растворились в азотной кислоте?
Опыт 11. Окислительные и восстановительные свойства серной кислоты.
а) Окисление сульфида натрия.
Внесите в пробирку 4 - 6 капель раствора сульфида натрия, 3 - 4 капли серной кислоты и несколько кристаллов сульфита натрия. Размешайте стеклянной палочкой содержимое пробирки для скорейшего растворения сульфита натрия.
Отметьте свои наблюдения и напишите уравнение реакции.
б) Восстановление дихромата калия. Внесите в пробирку 5 - 6 капель раствора дихромата калия, 3 - 4 капли серной кислоты и несколько кристаллов сульфита натрия.
Отметьте изменение окраски и напишите уравнение реакции.
Опыт 12. Взаимодействие серной кислоты с металлами.
а) Действие разбавленной серной кислоты на медь, железо и магний.
В три пробирки с 1 М раствором серной кислоты (5 - 8 капель) опустите: в первую - стружку меди? во вторую (на кончике микрошпателя) - порошок восстановленного железа, в третью - немного порошка магния. Во всех ли пробирках идет реакция? Как можно объяснить различие во взаимодействии взятых металлов с разбавленной серной кислотой? Напишите уравнения соответствующих реакций.
б) Взаимодействие концентрированной серной кислоты с медью. В тигель внесите немного медных опилок и 5 - 6 капель концентрированной серной кислоты. Тигель поставьте на кольцо штатива, подложив асбестовую сетку, и осторожно нагревайте. Влажную синюю лакмусовую бумагу подержите пинцетом над тиглем. По изменению цвета лакмусовой бумаги определите, какой газ выделяется.
Отставьте горелку, дайте тиглю охладиться, после чего внесите в него 8 - 10 капель дистиллированной воды. Какую окраску имеет раствор? Напишите уравнение реакции.
в) Взаимодействие концентрированной серной кислоты с цинком. В цилиндрическую пробирку поместите (на кончике микрошпателя) порошок цинка и добавьте 5 - 6 капель концентрированной серной кислоты. Пробирку укрепите в штативе и нагрейте на очень маленьком пламени горелки. Отметив появление в пробирке пузырьков сероводорода, подержите над ней пинцетом фильтровальную бумагу, пропитанную раствором соли свинца. Как изменился цвет бумаги?
Напишите уравнения соответствующих реакций.
Опыт 13. Окислительные и восстановительные свойства пероксида водорода.
а) Окисление иодида калия.
Поместите в пробирку три капли раствора иодида калия и одну каплю раствора серной кислоты. Добавьте одну каплю раствора пероксида водорода с массовой долей Н2О2, равной 3 %. Что наблюдается? Напишите уравнение реакции.
б) Восстановление перманганата калия. Поместите в пробирку 2 - 4 капли раствора перманганата калия и одну каплю 1 М H2SО4. Добавьте 1 - 2 капли раствора пероксида водорода с массовой долей Н2О2, равной 3 %. Как изменился цвет раствора? Какой газ выделяется? Напишите уравнение реакции.
Опыт 14. Окислительные свойства свободных галогенов.
а) Сравнение окислительной активности свободных галогенов. В три пробирки внесите по 3 - 5 капель растворов: в первую - бромида калия, в две другие - иодида калия. Во все пробирки добавьте по 2 - 4 капли бензола или бензина.
В две пробирки с растворами бромида и иодида калия добавьте по 2 - 4 капли хлорной воды, в третью пробирку с раствором иодида калия - бромной воды. Содержимое пробирок перемешайте стеклянной палочкой. Палочку каждый раз тщательно промывайте водой и вытирайте фильтровальной бумагой.
По окраске бензольного кольца определите, какой галоген выделяется в свободном состоянии в каждом случае. Напишите уравнения реакций взаимного вытеснения галогенов. Укажите окислитель и восстановитель в каждом случае. Как меняется окислительная способность галогенов от хлора к йоду? Сравните ваш вывод со значением окислительно-восстановительных потенциалов.
б) Окисление магния или цинка бромом. Внесите в пробирку 3 - 5 капель бромной воды и немного порошка магния или цинка. Перемешайте стеклянной палочкой. Отметьте обесцвечивание бромной воды и укажите причину этого явления. Напишите соответствующее уравнение реакции.
в) Окисление сероводорода галогенами. В три пробирки поместите по 5 - 6 капель: в первую - хлорной воды, во вторую - бромной и в третью - йодной. В каждую пробирку добавьте по 5 - 6 капель свежеприготовленной сероводородной воды до исчезновения окраски бромной и йодной воды. Наблюдайте помутнение растворов во всех пробирках. Чем это вызвано? Напишите соответствующие уравнения реакций.
Опыт 15. Реакция обнаружения галогенид – ионов.
а) Получение галогенидов серебра.
В три пробирки поместите по 3 - 4 капли растворов солей: в одну - хлорида, в другую - бромида, в третью - йодида. В каждую пробирку добавьте несколько капель раствора нитрата серебра до выпадения осадков.
Напишите уравнения реакций и укажите цвета осадков хлорида, бромида и иодида серебра.
б) Отношение галогенидов серебра к азотной кислоте и аммиаку. Каждый осадок, полученный в опыте 15 а), разделите на две пробирки и прилейте в одну из них 1 - 2 капли 2 М раствора азотной кислоты, в другую - раствор аммиака с массовой долей NH3, равной 25 %. Что наблюдается в каждом случае? Сделайте вывод об отношении галогенидов серебра к азотной кислоте и аммиаку.
Напишите уравнение растворения хлорида серебра в аммиаке, учитывая, что реакция сопровождается образованием комплексного соединения [Ag(NH3)2]Cl. Используя значения произведений растворимости галогенидов серебра, объясните неполную растворимость в аммиаке бромида серебра и практическую нерастворимость иодида серебра.
Опыт 16. Окислительные свойства гипохлоритов.
а) Окисление дигидроксида железа гипохлоритом натрия. Поместите в пробирку 2 - 3 кристаллика сульфата аммония-железа (II) - соли Mopa - FeSО4 · (NH4)2SО4 · 6Н2О и 2 - 3 капли дистиллированной воды. Встряхните пробирку, чтобы кристаллы растворились, и добавьте к раствору 2 - 4 капли гидроксида натрия. Отметьте цвет осадка. Какое вещество выпало в осадок в результате взаимодействия сульфата железа (II) с гидроксидом натрия. Прибавьте к осадку 3 - 5 капель раствора гипохлорита натрия NaOCl. Встряхните пробирку. Как изменился цвет осадка?
Напишите уравнение реакции, учитывая, что гипохлорит восстанавливается в хлорид и в реакции участвует вода.
б) Окисление соли свинца гипохлоритом кальция.
Поместите в пробирку 3 - 5 капель раствора ацетата свинца и сухого гипохлорит-хлорида кальция СаОСl2 (белильная, или хлористая известь). Пробирку нагрейте. Отметьте образование осадка диоксида свинца и его цвет.
Напишите соответствующее уравнение реакции.
Опыт 17. Окислительные свойства йодатов.
В пробирку поместите 2 - 3 капли раствора иодида калия и 1 - 2 капли 1 М раствора серной кислоты. Смесь размешайте стеклянной палочкой и добавляйте к ней по каплям раствор йодата калия КIO3 до появления бурой окраски йода.
Напишите уравнение реакции, учитывая, что как йодат-, так и йодид-ионы переходят в свободный йод.
Вопросы и задачи:
1. Напишите электронные формулы атомов элементов 3-го периода III - VII групп. Какую валентность в невозбужденном и возбужденном состояниях проявляют эти элементы?
2. Напишите уравнение реакции получения ортоборной кислоты.
3. Напишите уравнения реакций, протекающих при пропускании диоксида углерода через раствор известковой воды.
4. Напишите уравнение реакций растворения кремния в щелочах.
5. Какую реакцию среды имеют водные растворы Na2SnО2 и Sn(NО3)2? Напишите уравнения реакций гидролиза данных солей.
6. Напишите уравнение реакции получения Рb(ОН)2. Какими свойствами обладает этот гидроксид?
7. Может ли аммиак быть: а) окислителем; б) восстановителем? Почему? Составьте соответствующие уравнения реакций.
8. Составьте уравнения реакций взаимодействия нитрита натрия в кислой среде: а) с перманганатом калия; б) с йодидом калия. В каком из этих случаев нитрит натрия является окислителем, в каком - восстановителем?
9. Чем отличается действие разбавленной азотной кислоты на металлы от действия соляной и разбавленной серной кислот?
10. Укажите окислительные и восстановительные свойства сероводорода при его взаимодействии с другими веществами. Ответ подтвердите уравнениями реакций.
11. Дайте характеристику окислительно-восстановительных свойств серной и сернистой кислот.
12. Дайте сравнительную характеристику химических свойств галогенов, указав: а) строение их атомов; б) проявляемые каждым из них валентности; в) формулы водородных соединений.
13. Как изменяются окислительно-восстановительные свойства галогенов с увеличением их порядкового номера?
14. Допишите следующие уравнения, подберите к ним коэффициенты и укажите, что является восстановителем и окислителем в реакции:
а) 12 + С12 + Н2I → 13+ +...
б) Na2SO3 + FeCl3 + Н2O → Na2SO4 + FeCl2 +...
в) Zn + HNO3 → NH4NO3 +...
Список использованной литературы.
1. З.Г. Васильева, А.А. Грановская, А.А.Таперова. Лабораторные работы по общей и неорганической химии.
2. Сборник лабораторных работ по общей химии / Под ред. Н.В. Коровина, Т.Д. Титова, Э.И. Мингулиной, В.Н.Савельевой. – М.: МЭИ, 1974.
3. Лабораторный практикум по химии / Под ред. Р.А. Панича, Д.Г. Нарышкина. – М.: МЭИ, 1980.
4. Ахметов Н.С., Азизова М.К., Бадыгина Л.И. Лабораторные и семинарские занятия по неорганической химии. – М.: Высшая школа, 1979.
5. Григорьев А.П., Федотова О.Я. Лабораторный практикум по технологии пластических масс. – М.: Высшая школа, 1985.
6. Практикум по общей и неорганической химии / Под ред. М. Х. Карапетьянца, С.И. Дракина. – М: высшая школа, 1969.
7. Аверина А.В., Снегирева А. Я. Лабораторный практикум по органической химии. – М.: Высшая школа, 1975.
8. Хомченко Г.П. практикум по общей и неорганической химии с применением полумикрометода.: Учеб. Пособие для вузов. – М.: Высшая школа, 1980.
9. Практикум по общей химии / Под ред. Е.М. Соколовской, О.С. Зайцева. Изд-во МГУ, 1981.
10. Лабораторный практикум по общей химии / Под ред. А.А. Таперовой. – М.: Высшая школа, 1976.
Содержание
| Предисловие | |
| Общие указания к выполнению работ | |
| Правила оформления лабораторных работ | |
| Работа 1. Определение молекулярной массы газообразных веществ. | |
| Работа 2. Определение эквивалентов. | |
| Работа 3. Энергетика химических реакций. | |
| Работа 4. Скорость химической реакции. | |
| Работа 5. Химическое равновесие. Смещение химического равновесия. | |
| Работа 6. Растворимость веществ. Концентрация растворов. Приготовление растворов различной концентрации. | |
| Работа 7. Электролитическая диссоциация. Криоскопическое определение молекулярной массы и степень диссоциации. | |
| Работа 8. Водородный показатель среды рН. | |
| Работа 9. Гидролиз солей. | |
| Работа 10. Коллоидные растворы. | |
| Работа 11. Реакции в растворах электролитов. Произведение растворимости. | |
| Работа 12. Комплексные соединения. | |
| Работа 13. Окислительно-восстановительные реакции. | |
| Работа 14. Электрохимические процессы. | |
| Работа 15. Коррозия металлов. | |
| Работа 16. Определение жесткости и умягчение воды. | |
| Работа 17. Химические реакции между веществами в твердой фазе. Изучение мешающего влияния ионов. | |
| Работа 18. Металлы побочных подгрупп. | |
| Работа 19. Элементы групп III – VII главных подгрупп. | |
| Литература |
 2015-01-07
2015-01-07 1104
1104