Современная коллоидная химия – область науки, изучающая свойства веществ в дисперсном состоянии и поверхностные явления в дисперсных системах.
Дисперсной системой называется двух- или многофазная, т.е. гетерогенная система, в которой, по крайней мере, одна из фаз представлена очень маленькими частицами, размеры которых тем не менее заметно превосходят молекулярные. Частицы раздробленного вещества при этом называются дисперсной фазой, а гомогенная фаза, в которой они распределены (растворитель), представляет собой дисперсионную среду. Примерами дисперсных систем могут служить дымы, туманы, взвеси различных веществ, например глины в воде и т.д.
Поверхностные явления – это процессы, происходящие на границе раздела фаз, в межфазном поверхностном слое, и возникающие в результате взаимодействия сопряженных фаз, имеющих различный состав и строение.
Поверхность радела – это граничная область между фазами (конечный по толщине слой в несколько нм), в котором происходит изменение свойств от значений, характерных для одной фазы, до значений, характерных для другой.
|
|
|
Рассмотрим систему, состоящую из двух фаз, в одной из которых межмолекулярные взаимодействия сильнее, чем во второй, например систему газ – жидкость.
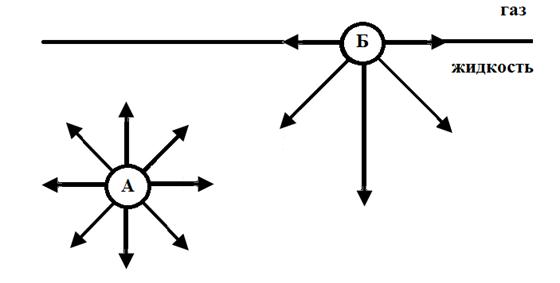
В жидкой фазе важнейшее свойство поверхностного слоя состоит в том, что в нем молекулы обладают избыточной энергией Гиббса по сравнению с молекулами, находящимися в объеме жидкой фазы. Наличие избыточной поверхностной энергии обусловлено не полной компенсацией межмолекулярных сил притяжения (F) у молекул поверхностного слоя (молекула Б) вследствие их слабого взаимодействия с граничной фазой. Силы притяжения, действующие на молекулу А со стороны окружающих ее молекул уравновешивают друг друга, их равнодействующая равно нулю. На молекулу Б со стороны граничных фаз действуют силы разного значения. Так как суммарные силы притяжения единицы объема жидкости много больше, чем суммарные силы притяжения единицы объема газа, равнодействующая сил у молекулы Б направлена вниз перпендикулярно границе раздела фаз. Под влиянием таких некомпенсированных сил находятся все молекулы поверхностного слоя жидкости.
Таким образом, для выведения молекулы из объем на поверхность надо преодолеть эту силу, то есть совершить работу и сообщить молекуле определенную энергию. Увеличение площади поверхности приводит к увеличению числа поверхностных молекул. При этом поверхностная энергия возрастает (ΔG >0)/
Работа, затраченная на образование единицы новой поверхности, называется поверхностным натяжением (σ): Gs = σ∙S, где Gs – поверхностная энергия Гиббса, S – площадь поверхности раздела фаз. Согласно данному определению единицы измерения σ – Дж/м2.
|
|
|
Еще одно определение поверхностного натяжения гласит, что σ – это сила, приложенная к единице длины контура на поверхности раздела фаз, стремящаяся сократить эту поверхность или препятствующая растеканию. Согласно данному определению единицы измерения σ - Н/м.
Возникновение поверхностных явлений является следствием стремления системы к самопроизвольному уменьшению поверхностной энергии Гиббса (Gs). Оно может происходить за счет:
- уменьшения межфазной поверхности в результате агрегации частиц дисперсной фазы (слипание мелких капель жидкости в более крупные, коагуляция твердых частиц);
В результате адгезии, адсорбции, образования ДЭС (двойного электрического слоя) и т.д.
 2015-01-21
2015-01-21 632
632








