Закон кратных отношений: Если два элемента образуют между собой несколько соединений, то массы одного элемента, соединяющиеся с одной и той же массой другого элемента, относятся между собой как небольшие целые числа.
Закон простых объемных отношений: При неизменных температуре и давлении объемы реагирующих газов относятся друг к другу и к объемам газообразных продуктов реакции как небольшие целые числа.
Состояние идеального газа (молекулы которых не взаимодействуют друг с другом) заданной массы характеризуется тремя параметрами: давлением P, объемом V и температурой Т. Между этими величинами экспериментально установлены следующие соотношения:
1) при постоянной температуре (закон Бойля-Мариотта):
P1 ∙ V1 = P2 ∙ V2 или P ∙ V = const;
2) при постоянном давлении (закон Гей-Люссака):
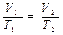 или
или 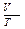 = const;
= const;
3) при постоянном объеме (закон Шарля):
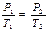 или
или 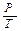 = const.
= const.
Из этих трех законов можно вывести один, объединенный газовый закон:
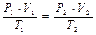 или
или 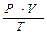 = const
= const
Уравнение для одного моль газа было выведено Д.И. Менделеевым:
|
|
|
P ∙ V = R ∙ T,
где R – универсальная газовая постоянная, R = 8,314 Дж/(моль ∙ К).
Для произвольного количества газа:
P ∙ V = n ∙ R ∙ T или 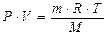 ,
,
которое называется уравнением Клапейрона-Менделеева.
Универсальная газовая постоянная представляет собой работу расширения одного моль газа при увеличении температуры его на один градус.
Закон Авогадро: в равных объемах любых газов при одинаковых условиях содержится одинаковое число молекул.
Следствия из закона Авогадро:
1. Один моль любого газа при одинаковых условиях занимает один и тот же объем. Объем, занимаемый одним моль газообразного вещества, называется молярным объемом (V0). При нормальных условиях (температура 0оС, давление 101,325 кПа) V0 = 22,4 л.
2. Один моль любого вещества содержит число Авогадро NA структурных единиц (молекул, атомов, ионов и др.): NA = 6,02 1023 моль-1.
Число атомов NA в 0,012 кг углерода (т.е. в 1моль) легко определить, зная массу атомов углерода (1,993 ∙ 10−26 кг):
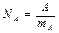 .
.
3. Относительная плотность газа по другому газу (отношение масс равных объемов различных газов равно отношению их молекулярных масс):
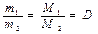
4. Парциальным давлением газа в газовой смеси называют давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси.
Закон парциальных давлений: Общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений ее составных частей.
 2015-02-27
2015-02-27 449
449








