Эквивалент вещества – это такое его количество, которое соединяется с одним моль атомов водорода или замещает то же количество в обменных реакциях или один моль электронов в окислительно-восстановительных реакциях.
Эквивалентной массой называется масса одного эквивалента вещества. Например, в соединениях эквиваленты хлора, кислорода, азота, углерода равны:
Э, моль mэ, г/моль
HCI 1 35,5
H2O 1/2 16/2 = 8
NH3 1/3 14/3 = 4,67
Эквивалент элемента вычисляют по формуле 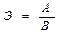 .
.
Эквивалент элемента зависит от валентности данного элемента в том или ином соединении, т.е. является переменной величиной.
Стехиометрические законы – это законы о количественном составе веществ и о количественных соотношениях между реагирующими веществами.
Закон сохранения массы: масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции.
Закон постоянства состава: всякое чистое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав.
|
|
|
Закон эквивалентов: массы реагирующих друг с другом веществ прямо пропорциональны их эквивалентным массам:
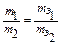 или
или 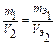 ,
,
где m1, m2 – массы веществ, вступающих в реакцию; 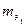 ,
, 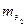 – эквивалентные массы этих веществ; V2 - объем второго вещества, приведенный к нормальным условиям;
– эквивалентные массы этих веществ; V2 - объем второго вещества, приведенный к нормальным условиям; 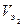 - эквивалентный объем второго вещества.
- эквивалентный объем второго вещества.
Эквивалентный объем – объем, занимаемый одним молем эквивалентов газообразного вещества при данных условиях.
При н.у. 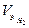 = 11,2 л;
= 11,2 л; 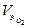 = 5,6 л.
= 5,6 л.
Закон эквивалентов применим и к сложным соединениям:
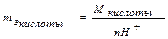
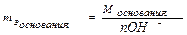
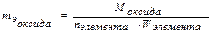
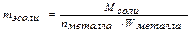
В окислительно-восстановительных реакциях:
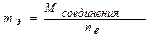
где nе – число электронов, отданных или принятых в реакции одной частицей.
 2015-02-27
2015-02-27 335
335








