Нейтрализация - один из распространенных методов очистки сточных вод, который основан на взаимодействии между ионами водорода Н+ и гидроксид-ионами ОН-, приводящая к образованию малодиссоциированных молекул воды.
Метод применяется для очистки кислых или щелочных вод.
Под щелочностью воды понимают содержание в воде веществ способных вступать в реакцию с сильными кислотами. Для нейтрализации используются растворы серной кислоты или кислые сточные воды.
Под кислотностью воды понимают содержание в воде веществ, вступающих в реакцию с сильными щелочами (едким натрием, едким калием, гидроксидом кальция и т.п.). В природных водах кислотность в большинстве случаев зависит только от содержания свободной растворенной угольной кислоты.
СО 2 +Н2О «Н2СО3 «Н ++НСО3+
Таблица 3.5.
Физико-химические свойства полимерных флокулянтов
| Флокулянт | Тип флокулянта | Товарный вид | Характеристи- ческая вязкость, дл/г в 10% NaCl | ММ 10-6 | Содержание ионогенных групп,% | Обменная емкость, мг-экв/г | Заряд, мВ |
| Полимеры акриламида серии АК 636: К 1020 К 555 К 580 | Слабокатионный Сильнокатионный Сильнокатионный | Порошок Порошок Порошок | - - - | 18-22 50-55 75-80 | 1,44 3,4 4,0 | + 79 - +46 | |
| Полимеры акриламида серии АК 631 А 930 А 1510 Н 150 | Среднеанионный Слабоанионный Неионный | Порошок Порошок Порошок | 20-30 5-10 | -59 -32 -25 | |||
| Флокатон 100 Флокатон 200 Флокатон 109 | Сильнокатионный Сильнокатионный Сильнокатионный | Гель 50% Гель 50% Гель 50% | 1,1 | 2,0 | 4,1 | +79 +59 +118 | |
| ВПК 101 ВПК 402 | Сильнокатионный Сильнокатионный | Жидкость 25% Жидкость 25% | 0,3 0,7 | 0,5 | 4,5 - | +37 +50 | |
| Полиакриламид | Слабоанионный | Гель 8% | - | 5,0 | 6-8 |
Флокатон 100 представляет собой сополимер акриламида и N – триметиламмоний этилматакрилатметилсульфата.
Флокатон 200 – сополимер акриламида и 1,2 диметил-5 -винилпиридинийметилсульфат.
Флокатон 109 – поли- N-триметиламмонийэтилметакрилата бензолсульфонат.
Часть кислотности, обусловленная присутствием гуминовых и других слабых органических кислот, растворенных в воде, называется естественной кислотностью, величина рН такой воды обычно составляет 4,5.
Промышленные сточные воды часто содержат:
1. Сильные кислоты (серную, соляную, азотную и др.)
2. Слабые кислоты (уксусная, сернистая, угольная, сероводородная и др.)
3.Соли слабых оснований (ионы железа (II,III), алюминия, меди (II) и др.). Соединения, содержащие эти катионы, подвергаются гидролизу с образованием ионов водорода.
Величина рН промышленных сточных вод может быть значительно ниже 4,5.
Кислотность воды определяется титрованием пробы воды раствором сильного основания.
Кислоты первой группы определяют титрованием анализируемой воды щелочью с индикатором метиловым оранжевым до перехода окраски из розовой в желтую. При этом изменение окраски наблюдается при величине рН 4,5
Количество 0,1 н. раствора сильного основания, при титровании которым значение рН исследуемой воды достигает величины 4,5, соответствует свободной кислотности воды (m). Таким способом может быть определено содержание сильных кислот в сточных водах.
Слабые кислоты при титровании щелочью образуют соответствующие им отрицательно заряженные ионы, например:
Н2СО3 + ОН -«НСО 3- + Н2О
СН3СООН + ОН- «СН3СОО - + Н2О
которые, в процессе гидролиза, придают раствору слабощелочную реакцию. Слабощелочная реакция среды создается также и при полном связывании некоторых катионов металлов в слабые основания.
Поэтому для определения кислотности такой воды надо применять индикаторы, изменяющие окраску в слабощелочной среде, например, тимолфталеин или фенолфталеин. У первого окраска проявляется при рН»9.4, а другого - при рН»8.4
Количество 0.1 н. раствора сильного основания, при титровании которым рН исследуемой воды достигает величины 8,4 или 9,4 соответствует общей кислотности воды.
Нейтрализация кислот может производиться любыми доступными щелочами или солями, образованными сильными основаниями и слабой кислотой: гидроксидом натрия, гидроксидом калия, известью, известняком, доломитом, мелом, содой, отходами производства щелочей и т. п.
В настоящее время дешевым и доступным реагентом является гидроксид кальция - Ca(OH)2 (гашеная известь).
На основании уравнений реакции нейтрализации можно рассчитать количество щелочи, необходимое для проведения процесса. Как указывалось выше, в большинстве промышленных сточных вод наряду с кислотами содержаться катионы металлов, которые при нейтрализации могут образовывать осадки соответствующих гидроксидов, например гидроксид железа (III), гидроксид меди (II) и др.
Теоретический расход щелочного реагента на нейтрализацию кислоты или осаждения гидроксидов металлов определяется по формуле

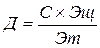 (3.12)
(3.12)
где С - концентрация кислоты или иона металла (г/л);
Эщ - молярная масса эквивалента щелочи (моль экв/л);
Эт - молярная масса эквивалента кислоты или катиона металла (моль экв/л).
Обычно необходимую дозу Ca(OH)2 для нейтрализации рассчитывают по активному оксиду кальция и принимают не менее 105% от теоретически рассчитанной.
Пример:
Нейтрализации подвергается сточная вода, содержащая 20 г/л серной кислоты и 110 мг/л ионов железа (III). Нейтрализация проводится гидроксидом кальция. Необходимо рассчитать расход товарной извести, содержащей 50% активного оксида кальция.
Решение:
Cоставим уравнение реакций нейтрализации:
1. H2SO4+ Ca(OH)2 ® CaSO4+ H2O
2. Fе2(SO4)3+ 3Ca(OH)2 ® 2Fe(OH)3 + 3CaSO4
Рассчитаем дозу Ca(OH)2, необходимую для проведения реакций:
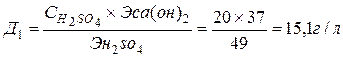
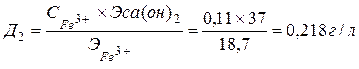
Общая доза Ca(OH)2 для нейтрализации:
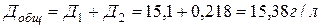
или в пересчете на активный оксид кальция (CaO):
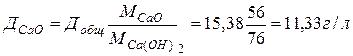
тогда 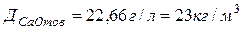 .
.
Химический контроль полноты нейтрализации осуществляется по изменению величины рН или по определению остаточной кислотности анализируемой воды.
 2015-02-04
2015-02-04 1191
1191








