Метод окисления применяют для обезвреживания сточных вод, содержащих токсичные примеси, имеющие восстановительные свойства (например: цианиды, фенолы, амины), для дезодорации дурнопахнущих стоков (например, сернисто-щелочных) или для обеззараживания воды в процессе водоподготовки.
Для всех этих процессов используют окислители: хлор, гипохлорит, диоксид хлора, озон, технический кислород и др. Метод окисления примесей соединениями хлора является одним из наиболее распространенных.
При введении хлора и хлорсодержащих агентов в сточную воду протекают реакции взаимодействия их с водой и органическими и неорганическими примесями. Скорость и глубина реакций зависят не только от природы примесей, но и от параметров процесса: температуры, рН, концентрации окислителя, времени контакта и т.д.
Хлор как окислитель, в зависимости от рН раствора, может находиться в воде в виде различных соединений. В сильнокислой среде возможно присутствие только молекулярного хлора. По мере уменьшения кислотности появляется хлорноватистая кислота (HOCl), а при щелочном рН – гипохлориты. Окислительная способность (стандартный окислительно-восстановительный потенциал) этих веществ различна:
| Cl2 + 2 е = 2Cl- | 1,36 В |
| HClО + Н+ + 2 е = Cl- + Н2О | 1,50 В |
| ClO- + Н2О + 2 е = Cl- + 2ОН- | 0,88 В |
Окисление цианидов (CN-) хлором можно проводить только в щелочной среде (рН 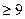 -10):
-10):
CN-+2OH-+Cl2 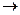 CNO-+2Cl-+H2O
CNO-+2Cl-+H2O
Образующиеся цианаты (CNO-) окисляются до элементарного азота и диоксида углерода:
2CNO - + 4OH -+ 3Cl2 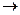 2CO2 + 6Cl - + N2 + 2H2O
2CO2 + 6Cl - + N2 + 2H2O
При снижении рН возможно протекание реакции прямого хлорирования цианида с образованием очень токсичного хлорциана:
CN- + Cl2 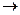 CNCl + Cl-
CNCl + Cl-
Более надежным и приемлемым методом является окисление гипохлоритами:
CN-+ OCl- 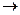 CNO- +Cl-
CNO- +Cl-
Реакция быстро и полно протекает при рН = 9-10. Образующиеся цианаты постепенно гидролизуются:
CNO- + 2H2O 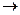 CO32- + NH4+
CO32- + NH4+
или окисляются избыточным количеством гипохлорита:
2CNO- + 3OCl- +2H+ 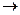 2CO2 + N2 + 3Cl- + H2O
2CO2 + N2 + 3Cl- + H2O
при оптимальной величине рН=6,6.
Следует отметить, что окисление цианидов и сероводорода протекает с большой скоростью – в течение 1-3минут.
Хлорирование – один из распространенных методов дезодорации сточных вод. Так, при дезодорации сточных вод производства сульфатной целлюлозы, содержащиеся в воде сернистые соединения (неорганические и органические) взаимодействуют с хлором с образованием различных продуктов. В зависимости от расхода хлора окисление метилмеркаптана может протекать по следующим реакциям:
2CH3SH + Cl2 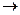 CH3SSCH3 + 2HCl
CH3SSCH3 + 2HCl
CH3SH + 2Cl2 + H2O 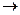 CH3SOCl + 3HCl
CH3SOCl + 3HCl
CH3SH + 3Cl2 + 2H2O 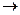 CH3SO2Cl + 5HCl
CH3SO2Cl + 5HCl
Подскипидарная вода, кроме метилмеркаптана, содержит диметилсульфид и диметилдисульфид, которые окисляются хлором гораздо медленнее. Время контакта сточной воды, загрязненной метилмеркаптаном, с хлором составляет 5 минут, а загрязненной диметилсульфидом и диметилдисульфидом – 45-60 минут
Очистка сточных вод азотной промышленности, производств аммиака, карбамида, аммиачной селитры направлена на обезвреживание аминосодержащих соединений (NH4+, NH4NO3, и др.).
Эффективным методом обезвреживания считается окисление по реакции:
2NH4+ + 3ClO- + 2OH- 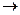 N2 + 3Cl- + 5H2O
N2 + 3Cl- + 5H2O
 2015-02-04
2015-02-04 924
924








