Большинство химических реакций обратимы, могут одновременно протекать в двух взаимно противоположных направлениях. Например:
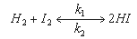
где k1 и k2 - константы скорости прямой и обратной реакции соответственно.
С течением времени скорость прямой реакции (Vпр) убывает, а обратной (Vобр) – возрастает и в конечном итоге они выравниваются. Состояние, при котором скорости прямой и обратной реакций равны, называется состоянием подвижного химического равновесия. Это состояние количественно характеризуется величиной константы равновесия (Kp), которая равна отношению констант скоростей прямой и обратной реакций k1 / k2 = const = Kp
Для реакции общего вида:
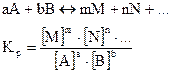
Таким образом, отношение произведения молярных концентраций продуктов реакции к произведению молярных концентраций исходных веществ в момент подвижного равновесия есть величина постоянная, называемая константой равновесия (закон действующих масс для равновесных систем). Чем больше величина Kp, тем полнее протекает прямая реакция. При Kp ® 0 наблюдается практически полное отсутствие химического взаимодействия.
 2015-04-01
2015-04-01 512
512








