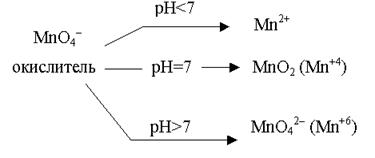
В зависимости от среды может измениться характер протекания процесса между одними и теми же веществами. Известно, например, что перманганат–ион является сильным окислителем, но его окислительные свойства зависят от pH среды. Наибольшую окислительную активность перманганат- ион (MnO4–) проявляет в кислой среде, восстанавливаясь до Mn2+. Меньшую – в нейтральной или слабощелочной средах, восстанавливаясь до Mn+4 (MnO2). Наименьшую – в сильнощелочной, восстанавливаясь до Mn+6 (MnO42–).
Выполнение опыта. В три пробирки внести по 3 – 4 капли раствора перманганата калия и добавить по 2 – 3 капли: в первую – 2 н. раствора серной кислоты, во вторую – воды, в третью – 2 н. раствора щелочи. Во все три пробирки внести по микрошпателю кристаллического сульфита натрия и перемешать растворы до полного растворения кристаллов. Через 1 – 2 мин. отметить обесцвечивание раствора в первой пробирке, выпадение бурого осадка во второй и быстро исчезающую зеленую окраску раствора в третьей.
Написать уравнения соответствующих реакций восстановления перманганата калия. При этом необходимо учесть, что перманганат- ион (MnO4–) в кислой среде переходит в Mn2+, в нейтральной – в MnO2, а в щелочной – в MnO42–. Сульфит-ион окисляется до сульфат-иона.
 2015-04-01
2015-04-01 6590
6590








