Таким образом, гибридизация связана с энергетическим выигрышем за счет более симметричного распределения электронной плотности внутри молекулы и образования более прочной связи.
Число гибридных орбиталей всегда равно числу исходных атомных ор-биталей. Гибридные орбитали образуются только в случае, если исходные орбитали не очень сильно отличаются по энергии. Так, 1s-орбитали не могут гибридизироваться с 2р-орбиталями, т. к. у них разное значение главного квантового числа, следовательно, большая разница в энергиях.
sр -гибридизация. Рассмотрим sр-гибридизацию на примере образования молекулы ВеСl2:
Be 2s2p0 → Be* 2s1p1
Для образования химической связи атом бериллия Ве должен перейти в возбужденное состояние Ве*. Образующийся возбужденный атом Ве* имеет два неспаренных электрона s и р, которые образуют две гибридные sp-орбитали. Атомы хлора Cl 3s2 3p5отдают для образования связи по одному неспаренному р-электрону (рис. 3.9). В результате их взаимодействия образуется линейная молекула BeCl2.
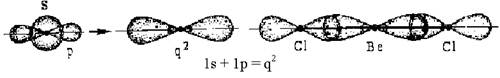
|
Рис. 3.9. Схема sp-гибридизации
sр2 -гибридизация. Комбинация трех орбиталей 1s + 2р = q3. Рассмотрим этот тип гибридизации на примере образования молекулы ВСl3 (рис. 3.10). Гибридные облака, формирующиеся из одного s-облака и двух р-облаков (их три), располагаются в пространстве под углом 120°, образуется плоская треугольная молекула.
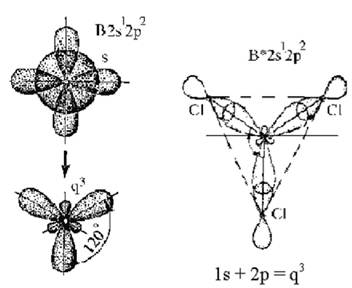
Рис. 3.10. Схема sp2-гибридизации
 2015-04-01
2015-04-01 461
461








