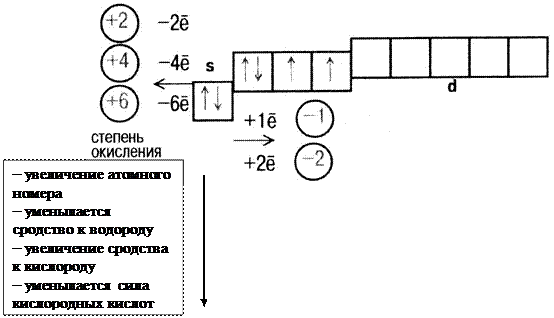
  О – голубой О – голубой
Se – красный Te – коричневый Ро |
| В природе:О составляет 47% земной коры, 21% воздуха. Входит в состав воды, горных пород, минеральных солей, белков, жиров, углеводов. |
| Получение: 1) В лаборатории: 2KClO3=KCl+3O2↑ (нагревание, кат. MnO2) 2KMnO4=K2MnO4+MnO2+O2↑ 2) В промышленности: из жидкого воздуха, электролизом воды. |
| Физические свойства. Аллотропные модификации | ||
| Кислород О2– газ без цвета, вкуса и запаха, немного тяжелее воздуха. В воде малорастворим. При t = –183˚C и р=101325 кПа переходит в жидкое состояние. | Озон О3 – газ с характерным запахом, разрушает органические вещества. О3 – более сильный окислитель, чем О2. О2 + энергия = 2О, О + О2 = О3 (электрический разряд) 2KI+O3+H2O=I2+2KOH+O2 (качественная реакция на О3) | |
| Химические свойства О2 | ||
1)
2) С металлами 2Mg+O2=2MgO 3) С щелочными металлами 2Na+O2=Na2O2 (пероксиды) 4) Со сложными веществами 2Fe2S3+9O2=2Fe2O3+6SO2 |
| Применение:в металлургии (для получения высоких температур); для получения HNO3, H2SO4; обжиг руд; в медицине (кислородные подушки и т.д.); в приборах для работы в подземных, подводных условиях, космических полетах. |
СЕРА S
| В природе:FeS2 – железный колчедан (пирит), CuSO4·2H2O – гипс, Na2SO4·10H2O – глауберова соль; в органических веществах. | |
| Получение: 1) 2H2S+O2=2S+2H2O (нагрев) (способ Клауса) 2) 2SO2+4H2S=6S+4H2O (NH4)2S5=(NH4)2S+4S (нагрев) | Физические свойства: S – твердое хрупкое вещество желтого цвета, не растворимо в воде, плохо проводит тепло и электричество. Ткип. = 444,6˚С. Аллотропные модификации: α-сера, β-сера, сера моноклинная (S8), сера ромбическая (S8), сера пластическая (Sn). |
| Химические свойства серы | |
| S – окислитель(нагревание) S + 2Na = Na2S; S + H2 = H2S | S – восстановитель S + O2 = SO2 (голубое пламя) |
 2015-04-01
2015-04-01 520
520